题目内容
5.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA | |
| B. | 0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为NA | |
| D. | 一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA |
分析 A.溶液体积未知;
B.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,计算;
C.气体摩尔体积使用对象为气体;
D.钠与氧气反应,无论生成氧化钠还是过氧化钠,钠都是由0价升高为+1价.
解答 解:A.依据n=CV可知,溶液体积未知,无法计算氯离子个数,故A错误;
B.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,0.2 mol Fe与足量水蒸气反应,生成氢气物质的量为:$\frac{0.8}{3}$mol,故B错误;
C.标况下水是液体,不能使用气体摩尔体积,故C错误;
D.钠与氧气反应,无论生成氧化钠还是过氧化钠,钠都是由0价升高为+1价,所以下2.3gNa物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,参加反应转移电子数为一定为0.1NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
15.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的 CuCl2•2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
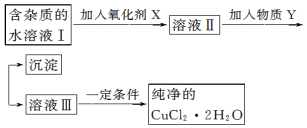
已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
请回答下列问题:
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.

已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的 pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的 pH | 3.0 | 9.0 | 6.7 |
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.
16.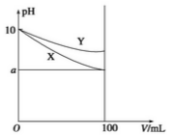 常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 若8<a<10,则X、Y 都是弱碱 | |
| B. | 稀释后,X 溶液的碱性比Y 溶液的碱性强 | |
| C. | X、Y 两种碱溶液中溶质的物质的量浓度一定相等 | |
| D. | 分别完全中和X、Y 这两种碱溶液时,消耗同浓度盐酸的体积VX>VY |
13.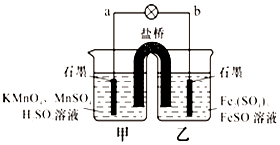 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
10.CO2的摩尔质量为( )
| A. | 44g | B. | 44g/mol | C. | 44 | D. | 22.4L/mol |
17.下列关于镁和钠的比较,结论正确的是( )
| A. | 铝镁合金的硬度较大,钠钾合金常温下为液态 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
14. 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )| A. | 该电池为原电池装置 | |
| B. | a与外接电源正极相连 | |
| C. | a电极的电极反应式为2CO2+6H++12e-═C2H5OH+3H2O | |
| D. | 当a电极上生成1 mol C2H5OH时,b电极上产生标准状况下的气体体积为67.2 L |
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题: