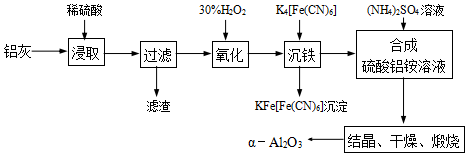
题目内容
2.标准状态下,4.48L的C2H4和C2H6混合气体充分燃烧得到CO和CO2混合气体的密度为1.429g/L,则其中CO的体积为6.72L.分析 根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量,然后利用碳原子守恒计算出CO和CO2的总物质的量;再根据M=ρVm计算出CO和CO2的平均摩尔质量,设出CO和CO2的物质的量,分别根据二者总物质的量、平均摩尔质量列式计算.
解答 解:设燃烧产物中CO和CO2的物质的量分别为x、y,
标准状况下4.48L C2H4和C2H6混合气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据C原子守恒可知CO和CO2的总物质的量为:x+y=0.2mol×2=0.4mol,
混合气体充分燃烧得到CO和CO2混合气体的密度为1.429g/L,则CO和CO2的平均摩尔质量为:22.4L/mol×1.429g/L=32,则:$\frac{28x+44y}{x+y}$=32,整理可得x:y=3:1,
则混合气体中CO的物质的量为:0.4mol×$\frac{3}{1+3}$=0.3mol,标况下0.3molCO的体积为:22.4L/mol×0.3mol=6.72L,
故答案为:6.72L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.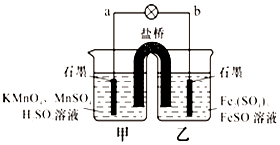 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
10.等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是( )
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
7.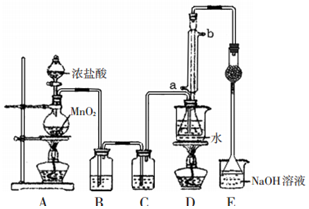 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
已知:S2Cl2易与水反应.
下列是几种物质的熔沸点.
(1)写出装置A中制备Cl2的化学反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中盛放试剂的作用是吸收Cl2中的HCl气体; 装置C中的试剂是浓硫酸.
(3)D装置中采用水浴加热的优点是受热均匀,温度易控制; 反应结束后,从D装置锥形瓶内的混合物中分离出产物S2Cl2的实验方法是蒸馏.
(4)装置E中倒扣漏斗的作用是防止倒吸.
(5)S2Cl2易与水反应,有淡黄色沉淀生成,产生的无色气体能使品红溶液褪色,写出该反应的化学方程式2S2Cl2+2H2O=3S↓+SO2↑+4HCl.
 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).已知:S2Cl2易与水反应.
下列是几种物质的熔沸点.
| 物质 | 沸点/℃ | 熔点/℃ |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
(2)装置B中盛放试剂的作用是吸收Cl2中的HCl气体; 装置C中的试剂是浓硫酸.
(3)D装置中采用水浴加热的优点是受热均匀,温度易控制; 反应结束后,从D装置锥形瓶内的混合物中分离出产物S2Cl2的实验方法是蒸馏.
(4)装置E中倒扣漏斗的作用是防止倒吸.
(5)S2Cl2易与水反应,有淡黄色沉淀生成,产生的无色气体能使品红溶液褪色,写出该反应的化学方程式2S2Cl2+2H2O=3S↓+SO2↑+4HCl.
14. 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )| A. | 该电池为原电池装置 | |
| B. | a与外接电源正极相连 | |
| C. | a电极的电极反应式为2CO2+6H++12e-═C2H5OH+3H2O | |
| D. | 当a电极上生成1 mol C2H5OH时,b电极上产生标准状况下的气体体积为67.2 L |
11.在钠和水的反应实验中,你观察不到的现象是( )
| A. | 酚酞试液从无色变为红色 | B. | 钠安静地浮在水面上 | ||
| C. | 钠熔化成光亮的小球 | D. | 钠在水面上到处游动 |
12.下列物质中同时含有氯气分子和氯离子的是( )
| A. | 液氯 | B. | 次氯酸 | C. | CaCl2溶液 | D. | 新制氯水 |
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题: