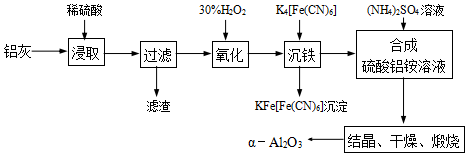
题目内容
5.下列离子方程式书写正确的是( )| A. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
分析 A.硝酸具有强的氧化性,能够氧化二价铁离子;
B.不符合反应客观事实;
C.氢氧化钠过量,铵根离子、碳酸氢根离子都参加反应;
D.碳酸氢钠少量,反应生成碳酸钙、氢氧化钠和水.
解答 解:A.氧化亚铁溶于稀硝酸,反应生成硝酸铁和水,正确的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,故A错误;
B.碳酸酸性弱于盐酸,氯化钙与二氧化碳、不反应,故B错误;
C.碳酸氢铵溶液中加入过量氢氧化钠溶液,离子方程式:NH4++HCO3-+2OH-=CO32-+H2O+NH3•H2O,故C错误;
D.向澄清石灰水中滴加少量的NaHCO3溶液,离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的正误判断,明确反应实质是解题关键,注意掌握离子方程式的书写原则,明确离子方程式正误判断方法,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
16.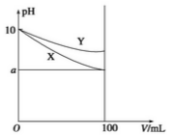 常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 若8<a<10,则X、Y 都是弱碱 | |
| B. | 稀释后,X 溶液的碱性比Y 溶液的碱性强 | |
| C. | X、Y 两种碱溶液中溶质的物质的量浓度一定相等 | |
| D. | 分别完全中和X、Y 这两种碱溶液时,消耗同浓度盐酸的体积VX>VY |
17.下列关于镁和钠的比较,结论正确的是( )
| A. | 铝镁合金的硬度较大,钠钾合金常温下为液态 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
1.向氯化铁溶液中加入过量氢氧化钠溶液 震荡后静置一段时间.下列关于该体系的说法中,不正确的是( )
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
10.等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是( )
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
14. 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )| A. | 该电池为原电池装置 | |
| B. | a与外接电源正极相连 | |
| C. | a电极的电极反应式为2CO2+6H++12e-═C2H5OH+3H2O | |
| D. | 当a电极上生成1 mol C2H5OH时,b电极上产生标准状况下的气体体积为67.2 L |
15.下列叙述正确的是( )
| A. | 常温下,0.1 mol•L-1 pH=8的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | pH=12氨水溶液与pH=2盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中:①NH4Al(SO4)2②NH4Cl③CH3COONH4④c(NH3•H2O);c(NH4+)由大到小的顺序是:①>②>③>④ | |
| D. | 某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-则在NaHA溶液中:c(Na+)=c(HA-)+c(A2-)+c(H2A) |
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题: