题目内容
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂.査阅文献:过氧化钙的制备方法一般有两种方案.利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2?8H2O沉淀.已知CaO2?8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2?2H2O,再在 140℃下烘0.5小时,得无水CaO2.加热至350℃左右开始分解放出氧气.已知某化工厂生产过氧化钙的主要工艺流程如下:某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量.
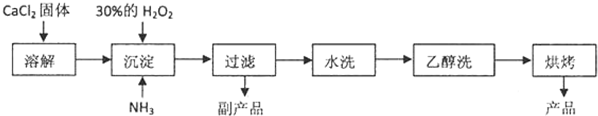
(1)用上述方法制取CaO2?8H2O的化学方程式是: .
(2)检验“水洗”是否合格的方法是: .
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2?8H2O产率;
② .
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32-=2I-+S4O62-】
①上述第三步滴定至终点,现象为 .
②CaO2的质量分数为 (用字母表示)

(1)用上述方法制取CaO2?8H2O的化学方程式是:
(2)检验“水洗”是否合格的方法是:
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2?8H2O产率;
②
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32-=2I-+S4O62-】
①上述第三步滴定至终点,现象为
②CaO2的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2?8H2O和氯化铵;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)②一方面该反应是放热反应,温度低有利于提高CaO2?8H2O产率;另一方面由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;
(4)①根据用Na2S2O3溶液滴定碘单质溶液判断滴定至终点的现象;
②CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O.所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,再根据质量分数=
进行计算;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)②一方面该反应是放热反应,温度低有利于提高CaO2?8H2O产率;另一方面由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;
(4)①根据用Na2S2O3溶液滴定碘单质溶液判断滴定至终点的现象;
②CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O.所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,再根据质量分数=
| m(CaO2) |
| m(总) |
解答:
解:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2?8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl;故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)②由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率,故答案为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率;
(4)①根据用Na2S2O3溶液滴定碘单质溶液,滴定至终点,现象为最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色,故答案为:最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色;
②CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O.所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,所以CaO2的质量分数为
=
;故答案为:
;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)②由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率,故答案为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率;
(4)①根据用Na2S2O3溶液滴定碘单质溶液,滴定至终点,现象为最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色,故答案为:最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色;
②CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O.所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,所以CaO2的质量分数为
| 0.0005cV×72 |
| a |
| 36cV×10 -3 |
| a |
| 36cV×10 -3 |
| a |
点评:本题考查了CaO2的制备及其测定其中CaO2的含量的测定实验,题目难度中等,解答关键是读懂题干信息、依据反应条件计算判断,试题充分培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、1 mol H2O的质量为18g/mol |
| B、-20℃,18g H2O中含有2mol H和1mol O |
| C、将2mol NaOH 溶于1L水中配成溶液的浓度为2mol?L-1 |
| D、3.01×1023个SO2分子的质量为64g |
在酸性溶液中能大量共存而且为无色透明的溶液是( )
| A、NH4+、Al3+、SO42-、NO3- |
| B、K+、Cu2+、Cl-、CO32- |
| C、K+、MnO4-、NH4+、NO3- |
| D、Na+、K+、HCO3-、NO3- |
若X、Y为同周期元素,且电负性X>Y,下列说法肯定错误的是( )
| A、X与Y形成化合物时,X显负价,Y显正价 |
| B、X的第一电离能大于Y |
| C、X的原子序数小于Y |
| D、气态氢化物的稳定性X强于Y |
下列电离方程式中,正确的是( )
| A、H2SO4=H2++SO42- |
| B、Ba(OH)2=Ba2++OH- |
| C、NaNO3=Na++NO3- |
| D、MgSO4═Mg+2+SO4-2 |