题目内容
为研究某铁质材料与浓硫酸反应生成气体的成分,某学习小组进行了以下探究活动:
(1)称取铁钉5.6g放入20mL足量浓硫酸中,加热,理论上收集到气体SO2 L(标况).将所得气体全部通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体23.3g.由此推知实际生成气体SO2的体积为 L(标况).
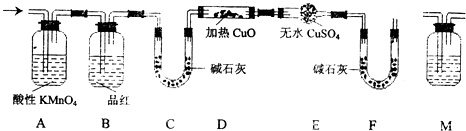
(2)分析上述实验中SO2体积的结果,有同学认为所得气体中除含有SO2外,还可能含有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略).
①装置A中试剂的作用是
②认为气体中还含有的Q气体是
③为确认Q的存在,需在装置中添加M于 ,
a.A之前b.AB之间c.BC之间d.CD之间M中的试剂是
④如果气体中含有H2,预计实验现象应是
(1)称取铁钉5.6g放入20mL足量浓硫酸中,加热,理论上收集到气体SO2
(2)分析上述实验中SO2体积的结果,有同学认为所得气体中除含有SO2外,还可能含有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略).
①装置A中试剂的作用是
②认为气体中还含有的Q气体是
③为确认Q的存在,需在装置中添加M于
a.A之前b.AB之间c.BC之间d.CD之间M中的试剂是
④如果气体中含有H2,预计实验现象应是

考点:探究物质的组成或测量物质的含量
专题:
分析:(1)根据铁与浓硫酸反应的方程式进行计算;根据硫守恒,由硫酸钡的质量计算硫酸钡的物质的量,即得二氧化硫的物质的量进行计算;
(2)①根据实验目的,A中高锰酸钾是除去二氧化硫;
②根据浓硫酸具有强氧化性及铁钉中含碳,所以浓硫酸可能将碳氧化成二氧化碳;
③根据铁钉的成分分析,铁钉中的铁和碳在加热条件下都能与浓硫酸发生氧化还原反应;
④根据二氧化硫和二氧化碳的性质分析选择位置;
⑤根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝.
(2)①根据实验目的,A中高锰酸钾是除去二氧化硫;
②根据浓硫酸具有强氧化性及铁钉中含碳,所以浓硫酸可能将碳氧化成二氧化碳;
③根据铁钉的成分分析,铁钉中的铁和碳在加热条件下都能与浓硫酸发生氧化还原反应;
④根据二氧化硫和二氧化碳的性质分析选择位置;
⑤根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝.
解答:
解:(1)铁与浓硫酸加热反应的方程式为2Fe+6H2SO4
Fe2(SO4)3+3SO2+6H20,根据方程式5.6g放入20mL足量浓硫酸中,加热,理论上收集到气体SO2体积为
×
×22.4=3.36L;将所得气体全部通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体23.3g即
=0.1mol,根据硫守恒所以实际生成气体SO2也为0.1mol,体积为2.24L,故答案为:3.36L;2.24L;
(2)①根据实验目的,A中高锰酸钾是除去二氧化硫;故答案为:除去气体中的SO2;
②根据浓硫酸具有强氧化性及铁钉中含碳,所以浓硫酸可能将碳氧化成二氧化碳,所以认为气体中还含有的Q气体是二氧化碳,故答案为:CO2;
③Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,故答案为:c;澄清石灰水;
④氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,故答案为:D中固体由黑色变红和E中固体由白变蓝.
| ||
| 5.6 |
| 56 |
| 3 |
| 2 |
| 23.3 |
| 233 |
(2)①根据实验目的,A中高锰酸钾是除去二氧化硫;故答案为:除去气体中的SO2;
②根据浓硫酸具有强氧化性及铁钉中含碳,所以浓硫酸可能将碳氧化成二氧化碳,所以认为气体中还含有的Q气体是二氧化碳,故答案为:CO2;
③Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,故答案为:c;澄清石灰水;
④氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,故答案为:D中固体由黑色变红和E中固体由白变蓝.
点评:本题考查了浓硫酸、二氧化硫的性质等知识点,难度较大,易错题是(2)②,容易忽略铁钉中的碳而导致该题不会分析.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列离子方程式正确的是( )
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铜跟稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
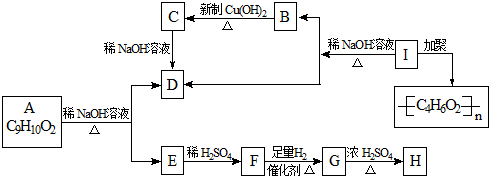
已知:

则符合要求的C5H10O2的结构有( )

则符合要求的C5H10O2的结构有( )
| A、1种 | B、2种 | C、4种 | D、5种 |
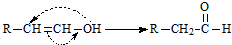 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系