题目内容
若X、Y为同周期元素,且电负性X>Y,下列说法肯定错误的是( )
| A、X与Y形成化合物时,X显负价,Y显正价 |
| B、X的第一电离能大于Y |
| C、X的原子序数小于Y |
| D、气态氢化物的稳定性X强于Y |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:若X、Y为同周期元素,且电负性X>Y,则原子序数X>Y,
A.电负性越大的元素吸引电子能力越强,在化合物中显负化合价;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
C.同一周期,元素的电负性随着原子序数增大而增大;
D.同一周期,元素的电负性越大其非金属性越强,非金属性越强的元素其气态氢化物越稳定.
A.电负性越大的元素吸引电子能力越强,在化合物中显负化合价;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
C.同一周期,元素的电负性随着原子序数增大而增大;
D.同一周期,元素的电负性越大其非金属性越强,非金属性越强的元素其气态氢化物越稳定.
解答:
解:若X、Y为同周期元素,且电负性X>Y,则原子序数X>Y,
A.电负性越大的元素吸引电子能力越强,在化合物中显负化合价,电负性X>Y,所以X、Y形成的化合物中,X显负化合价、Y显正化合价,故A正确;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,如果X位于第VIIA族、Y位于第VIA族,则第一电离能X>Y,如果X位于第VIA族、Y位于第VA族,则电负性X<Y,所以X的第一电离能可能大于Y,故B正确;
C.同一周期,元素的电负性随着原子序数增大而增大,电负性X>Y,则原子序数X>Y,故C错误;
D.同一周期,元素的电负性越大其非金属性越强,非金属性越强的元素其气态氢化物越稳定,电负性X>Y,则非金属性X>Y,所以气态氢化物的稳定性X强于Y,故D正确;
故选C.
A.电负性越大的元素吸引电子能力越强,在化合物中显负化合价,电负性X>Y,所以X、Y形成的化合物中,X显负化合价、Y显正化合价,故A正确;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,如果X位于第VIIA族、Y位于第VIA族,则第一电离能X>Y,如果X位于第VIA族、Y位于第VA族,则电负性X<Y,所以X的第一电离能可能大于Y,故B正确;
C.同一周期,元素的电负性随着原子序数增大而增大,电负性X>Y,则原子序数X>Y,故C错误;
D.同一周期,元素的电负性越大其非金属性越强,非金属性越强的元素其气态氢化物越稳定,电负性X>Y,则非金属性X>Y,所以气态氢化物的稳定性X强于Y,故D正确;
故选C.
点评:本题考查原子结构和元素周期律知识,明确电负性、第一电离能、非金属性与气态氢化物的稳定性强弱关系等元素周期律是解本题关键,注意第一电离能规律中的异常现象,题目难度不大.

练习册系列答案
相关题目
下列盐中,既不是碱式盐,也不是酸式盐的是( )
| A、NaHSO4 |
| B、Cu2(OH)2CO3 |
| C、NH4NO3 |
| D、Ca(H2PO4)2 |
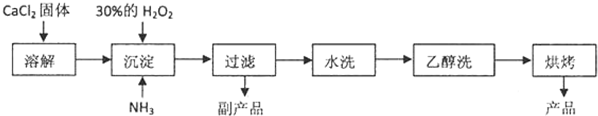
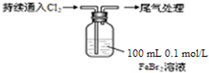
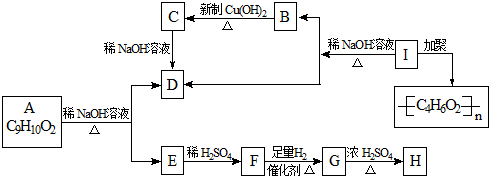
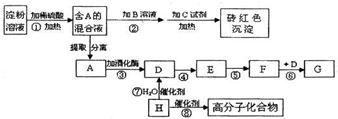
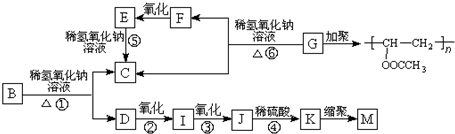
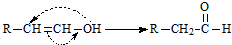 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系