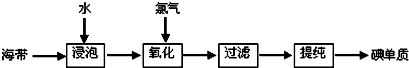
题目内容
某液体化合物X2Y4,常用做火箭燃料.16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)═X2(g)+2Y2O(l).Y2O常温下为常见的液体.冷却后标准状况下测得气体生成物的体积为11.2L,其密度为1.25g/mol,则:
(1)求反应前O2在标准状况下的体积V(O2).
(2)求X2的摩尔质量;X、Y分别为什么元素?(均要有推断过程.)
(1)求反应前O2在标准状况下的体积V(O2).
(2)求X2的摩尔质量;X、Y分别为什么元素?(均要有推断过程.)
考点:化学方程式的有关计算
专题:
分析:(1)由方程式可知,反应前后气体的体积不发生变化,据此计算氧气的体积;
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称.
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称.
解答:
解:(1)由方程式可知,反应前后气体的体积不发生变化,X2和氧气的关系式为1:1,故V(O2)=V(X2)=11.2L,
故答案为:11.2L;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28g/mol,
11.2L X2的物质的量=
=0.5mol,n(X2Y4)=n(X2)=0.5mol,故Mr(X2Y4)=
=32,则Y的相对原子质量=
=1,故Y为氢元素,X为N元素.
故答案为:X2的摩尔质量是28g/mol;X为氢,Y为氮.
故答案为:11.2L;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28g/mol,
11.2L X2的物质的量=
| 11.2L |
| 22.4L/mol |
| 16 |
| 0.5 |
| 32-28 |
| 4 |
故答案为:X2的摩尔质量是28g/mol;X为氢,Y为氮.
点评:本题考查化学方程式的有关计算,难度不大,注意根据方程式的特征计算氧气的体积,理解气体的摩尔质量与密度的关系.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列说法错误的是( )
| A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| B、某主族元素X的气态基态原子的逐级电离能分别是578、1817、2745、11575、14830、18376(kJ?mol-1)…,它与氯气反应所生成的物质的化学式为XCl2 |
| C、元素周期表中,处于非金属三角区边界的锗的电负性为1.8,则可以推测电负性为4.0的元素为非金属元素 |
| D、因为Be和Al的电负性都是1.5,所以处于周期表对角线位置的Be和Al的某些性质相似 |
A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是:( )
| 物质 编号 | 物质转化关系 | A | D | E |
| ① |  | Si | SiO2 | H2SiO3 |
| ② | N | NO2 | HNO3 | |
| ③ | S | SO2 | H2SO4 | |
| ④ | Na | Na2O2 | NaOH |
| A、①②③④ | B、②③ |
| C、①③④ | D、②④ |
下列离子方程式正确的是( )
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铜跟稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
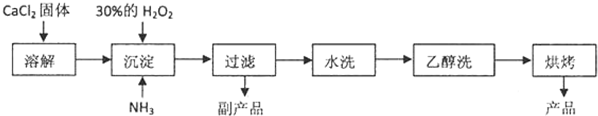
 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系