题目内容
下列电离方程式中,正确的是( )
| A、H2SO4=H2++SO42- |
| B、Ba(OH)2=Ba2++OH- |
| C、NaNO3=Na++NO3- |
| D、MgSO4═Mg+2+SO4-2 |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:首先判断电解质的强弱,强电解质完全电离,弱电解质部分电离,多元弱酸以第一步电离为主.
解答:
解:A、H2SO4为强电解质,完全电离,电离方程式为:H2SO4=2H++SO42-,故A错误;
B、Ba(OH)2为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故B错误;
C、NaNO3是强电解质,完全电离,电离方程式为:NaNO3=Na++NO3-,故C正确;
D、MgSO4为强电解质,完全电离,电离方程式为:MgSO4═Mg2++SO42-,故D错误.
故选C.
B、Ba(OH)2为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故B错误;
C、NaNO3是强电解质,完全电离,电离方程式为:NaNO3=Na++NO3-,故C正确;
D、MgSO4为强电解质,完全电离,电离方程式为:MgSO4═Mg2++SO42-,故D错误.
故选C.
点评:本题考查电离方程式的书写,题目难度不大,注意弱电解质的电离方程式的书写方法.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
由K2SO4、Al2(SO4)3 和Na2SO4 组成的混合溶液,c(Na+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42-)=0.8mol/L,则 c(K+)为( )
| A、0.15 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4mol/L |
下列实验操作正确的是( )
A、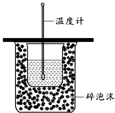 用如图装置测定中和热 |
| B、中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化 |
| C、研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 |
| D、测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
下列实验操作中正确的是( )
| A、为了节约火柴,用燃着的酒精灯引燃另一盏酒精灯 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水的大 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、蒸馏操作时,应使用温度计水银球应放到溶液中测量溶液的温度 |