题目内容
氰气[(CN)2]性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是( )
| A、是极性分子 |
| B、键长:N≡C大于C≡C |
C、CN-的电子式: |
| D、能与烯烃发生加成反应 |
考点:氯、溴、碘及其化合物的综合应用
专题:
分析:A.结构为N≡C-C≡N,为非极性分子;
B.根据原子半径比较键长;
C.电子式为 ;
;
D.含有不饱和键,可发生加成反应.
B.根据原子半径比较键长;
C.电子式为
 ;
;D.含有不饱和键,可发生加成反应.
解答:
解:A.结构为N≡C-C≡N,结构对称,为非极性分子,为A错误;
B.N原子半径小于C,则键长:N≡C小于C≡C,故B错误;
C.电子式为 ,故C错误;
,故C错误;
D.含有不饱和键,可发生加成反应,故D正确.
故选D.
B.N原子半径小于C,则键长:N≡C小于C≡C,故B错误;
C.电子式为
 ,故C错误;
,故C错误;D.含有不饱和键,可发生加成反应,故D正确.
故选D.
点评:本题考查了物质的组成、结构和性质的关系,涉及电子式的书写等知识,题目难度较大,可以根据已知的乙炔的结构、卤素的性质结合元素周期律来分析解答,试题有利于培养学生的知识迁移能力.

练习册系列答案
相关题目
下列各组离子在水溶液中因发生氧化还原反应而不能大量共存的是( )
| A、H+、K+、CO32-、HCO3- |
| B、Na+、Fe3+、Cl-、I- |
| C、K+、Al3+、NO3-、AlO2- |
| D、K+、Br-、HCO3-、CO32- |
下列离子方程式正确的是( )
| A、铁粉和氯化铁溶液反应 Fe+Fe3+═Fe2+ |
| B、铁和稀盐酸反应 Fe+2H+═Fe2++H2↑ |
| C、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| D、铝和氢氧化钠溶液反应 2Al+2OH-=2AlO2-+3H2↑ |
短周期主族元素X、Y、Z、W原子序数依次增大,已知Y是四种元素中金属性最强的元素,Y、Z、W同周期,且三种元素原子的最外层电子数之和为11,X2-和Y+具有相同的电子层结构,下列叙述正确的是( )
| A、离子半径:X2->Y+ |
| B、原子的最外层电子数:X>Y>Z>W |
| C、单质沸点:X>Y>Z>W |
| D、X与Y形成的化合物中只2含有离子键 |
用石墨作电极电解0.1mol?L-1的CuSO4溶液,当有0.4mol电子通过电路时,发现阴极增重6.4g,则要使电解后的溶液恢复到原始状态,则应向电解后的溶液中加入( )
| A、0.1molCu(OH)2 |
| B、0.1molCuO |
| C、0.2molCuO |
| D、0.1molCuO和0.2molH2O |
下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )
| A、属于酯类的有4种 |
| B、属于羧酸类的有2种 |
| C、存在分子中含有六元环的同分异构体 |
| D、既含有羟基又含有醛基的有3种 |
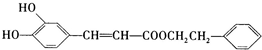 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: