题目内容
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子核外电子排布式为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号).
a.Cl2、Br2、I2的熔点
b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
NaClO3溶液
KClO3晶体II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 .
SiCl4(粗) SiCl4460℃Cl2Si(粗)蒸馏1100℃H2Si(纯)
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如下:Si(粗)
SiCl4
SiCl4(粗)
Si(纯)写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式: .
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目 .
(1)与氯元素同族的短周期元素的原子核外电子排布式为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点
b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
SiCl4(粗) SiCl4460℃Cl2Si(粗)蒸馏1100℃H2Si(纯)
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如下:Si(粗)
| Cl2 |
| 460℃ |
| 蒸馏 |
| H2 |
| 1100℃ |
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
考点:氯、溴、碘及其化合物的综合应用,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:(1)与氯元素同族的短周期元素原子为F,再根据核外电子排布规律来写;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液NaClO3溶液KClO3晶体,电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(4)四氯化硅为共价化合物,化学式中存在4个硅铝键;根据题中数据及热化学方程式的书写方法写出该反应的热化学方程式;
(5)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液NaClO3溶液KClO3晶体,电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(4)四氯化硅为共价化合物,化学式中存在4个硅铝键;根据题中数据及热化学方程式的书写方法写出该反应的热化学方程式;
(5)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
解答:
解:(1)与氯元素同族的短周期元素原子为F,核外有9个电子,F的核外电子排布式为1s22s22p5,故答案为:1s22s22p5;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下,KClO3在水中的溶解度明显小于其它晶体;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为: ;
;
7kg纯硅的物质的量为:
=250mol,生成250mol硅吸收akJ热量,则生成1mol硅吸收的热量为:
=0.004akJ,所以四氯化硅气体与氢气反应生成单质硅和氯化氢的热化学方程式为:2H2(g)+SiCl4(g)=Si(s)+4HCl(g)△H=+0.004akJ?mol-1,
故答案为: ;2H2(g)+SiCl4(g)=Si(s)+4HCl(g)△H=+0.004akJ?mol-1;
;2H2(g)+SiCl4(g)=Si(s)+4HCl(g)△H=+0.004akJ?mol-1;
(5)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,反应的离子方程式和电子转移为: ;
;
故答案为: ;
;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下,KClO3在水中的溶解度明显小于其它晶体;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为:
 ;
;7kg纯硅的物质的量为:
| 7000g |
| 28g/mol |
| aKJ |
| 250 |
故答案为:
 ;2H2(g)+SiCl4(g)=Si(s)+4HCl(g)△H=+0.004akJ?mol-1;
;2H2(g)+SiCl4(g)=Si(s)+4HCl(g)△H=+0.004akJ?mol-1;(5)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,反应的离子方程式和电子转移为:
 ;
;故答案为:
 ;
;
点评:本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算、离子方程式书写和氧化还原反转移电子数的计算和表示方法,为高考常见题型,侧重于学生计算能力、分析比较能力的培养,题目难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列叙述正确的是( )
| A、pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl溶液恰好无色,则此时溶液的pH<7 |
| C、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| D、0.2 mol?L-1的盐酸与等体积水混合后pH=1 |
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中M化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:MFe2Ox
MFe2Oy下列判断正确的是( )
| 常温下 |
| SO2 |
| A、SO2是该反应的催化剂 |
| B、MFe2Ox是还原剂 |
| C、x>y |
| D、SO2发生了置换反应 |
短周期主族元素X、Y、Z、M、W在元素周期表中的相对位置如表,其中Z的核电荷数是Y 的两倍.下列说法正确的是( )
| X | Y | |
| W | M | Z |
| A、M位于元素周期表中第三周期ⅣA族 |
| B、原子半径:Z>M>X |
| C、气态氢化物的热稳定性:Y>X>W |
| D、W的氧化物既能与NaOH反应,也能与HF反应,属于两性氧化物 |
关于硫及其化合物的说法中,正确的是( )
| A、硫不溶于水,易溶于酒精和二硫化碳 |
| B、SO2具有强还原性,常用作漂白剂,在漂泊过程中被氧化 |
| C、氢硫酸空气中可以被氧化,被空气氧化后溶液的酸性减弱 |
| D、浓硫酸与铜反应需要持续加热,一旦停止加热反应将不再进行 |
氰气[(CN)2]性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是( )
| A、是极性分子 |
| B、键长:N≡C大于C≡C |
C、CN-的电子式: |
| D、能与烯烃发生加成反应 |
化学与生活息息相关,下列说法正确的是( )
| A、SO2、CO2和NO2都是可形成酸雨的气体 |
| B、棉、麻和油脂都是高分子化合物 |
| C、氧化铝陶瓷和光导纤维都是无机非金属材料 |
| D、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
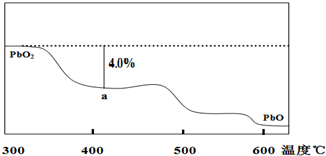 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题: