题目内容
下列离子方程式正确的是( )
| A、铁粉和氯化铁溶液反应 Fe+Fe3+═Fe2+ |
| B、铁和稀盐酸反应 Fe+2H+═Fe2++H2↑ |
| C、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| D、铝和氢氧化钠溶液反应 2Al+2OH-=2AlO2-+3H2↑ |
考点:离子方程式的书写
专题:
分析:A.电子、电荷不守恒;
B.反应生成氯化亚铁和氢气;
C.HClO在离子反应中保留化学式;
D.漏写氧化剂水.
B.反应生成氯化亚铁和氢气;
C.HClO在离子反应中保留化学式;
D.漏写氧化剂水.
解答:
解:A.铁粉和氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故A错误;
B.铁和稀盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,故B正确;
C.氯气通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.铝和氢氧化钠溶液反应的离子反应为2H2O+2Al+2OH-=2AlO2-+3H2↑,故D错误;
故选B.
B.铁和稀盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,故B正确;
C.氯气通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.铝和氢氧化钠溶液反应的离子反应为2H2O+2Al+2OH-=2AlO2-+3H2↑,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| ||
| A、1mol KClO3参加反应,生成气体的体积为44.8L |
| B、H2C2O4在反应中被还原 |
| C、ClO2是氧化产物,它可用来净水,在净水时作氧化剂 |
| D、生成1mol ClO2,反应中转移的电子有1 mol |
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A、X的最高价氧化物能溶于强碱 |
| B、非金属性:T<R |
| C、气态氢化物稳定性:T>Z |
| D、R与Q的原子核外电子数相差16 |
氰气[(CN)2]性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是( )
| A、是极性分子 |
| B、键长:N≡C大于C≡C |
C、CN-的电子式: |
| D、能与烯烃发生加成反应 |
在常温常压下,某实验小组按如图做完实验后,实验报告记录如下.其中描述合理的是( )

| A、①②③ | B、②③④ |
| C、②⑤⑥ | D、③④⑥ |
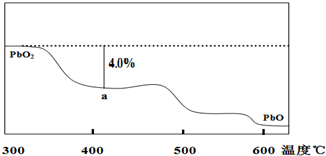 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题: 光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.
光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.