题目内容
如表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:

请按要求回答下列问题:
(1)写出③的元素符号 .
(2)7种元素中,原子半径最小的是 (填序号).
(3)元素④的氢化物与元素⑦的单质反应的离子方程式为 .
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为 (用化学式表示).
(5)元素②形成的最简单氢化物的空间结构为 .

请按要求回答下列问题:
(1)写出③的元素符号
(2)7种元素中,原子半径最小的是
(3)元素④的氢化物与元素⑦的单质反应的离子方程式为
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为
(5)元素②形成的最简单氢化物的空间结构为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,据此解答各小题即可.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,
(1)依据分析可知:③为N,故答案为:N;
(2)H原子只有1个电子层,其原子半径最小,故答案为:①;
(3)元素O的氢化物为水,氯气与水反应生成盐酸和次氯酸,氧化物不能拆,单质不能拆,此反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH>Al(OH)3,故答案为:NaOH>Al(OH)3;
(5)甲烷为正四面体结构,故答案为:正四面体.
(1)依据分析可知:③为N,故答案为:N;
(2)H原子只有1个电子层,其原子半径最小,故答案为:①;
(3)元素O的氢化物为水,氯气与水反应生成盐酸和次氯酸,氧化物不能拆,单质不能拆,此反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH>Al(OH)3,故答案为:NaOH>Al(OH)3;
(5)甲烷为正四面体结构,故答案为:正四面体.
点评:本题考查元素周期表与元素周期律综合应用,侧重考查元素周期律与化学用语,注意对元素周期表整体把握,理解元素周期律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
强弱电解质的本质区别是( )
| A、导电能力 | B、化学键的类型 |
| C、溶解度 | D、电离程度 |
下列条件下,两物质所含分子数不相等的是( )
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
下列关于各图象的解释或结论正确的是( )
A、.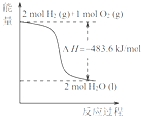 热化学方程式是H2(g)+
| ||
B、.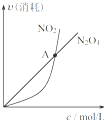 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | ||
C、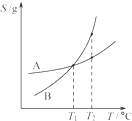 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | ||
D、.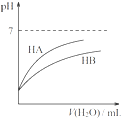 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 |
向体积为VL的NaALO2溶液中,开始通入amolHCl气体,则有bmol沉淀析出,继续通入cmolHCl气体后,产生的沉淀又恰好溶解,则原NaAlO2溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列离子方程式中,正确的是( )
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、在常温下,22.4L氧气所含的分子总数为NA |
| B、在标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 |
| C、标准准况下,22.4L 乙醇中含有NA个乙醇分子 |
| D、在1L 0.1mol/L的碳酸钠溶液中,所含Na+的数目为0.2NA |
将质量为W1克的钠、铝共融物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体W2克.n(Na)、n(Al)分别代表钠、铝的物质的量,下列关系式中不正确的是( )
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |