题目内容
将质量为W1克的钠、铝共融物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体W2克.n(Na)、n(Al)分别代表钠、铝的物质的量,下列关系式中不正确的是( )
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |
考点:有关混合物反应的计算
专题:
分析:钠、铝共融物投入一定量的水中可发生:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸体积为V2L时,溶液的溶质为NaCl和AlCl3.
A.蒸干过程氯化铝水解,得到NaCl与氢氧化铝,灼烧得到固体为NaCl、Al2O3,W2-W1为固体中O元素、Cl元素质量之和;
B.金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,据此计算判断;
C.根据方程式表示出Na、Al与生成氢气的物质的量关系,再结合氢气的体积列出等量关系;
D.aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量.
A.蒸干过程氯化铝水解,得到NaCl与氢氧化铝,灼烧得到固体为NaCl、Al2O3,W2-W1为固体中O元素、Cl元素质量之和;
B.金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,据此计算判断;
C.根据方程式表示出Na、Al与生成氢气的物质的量关系,再结合氢气的体积列出等量关系;
D.aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量.
解答:
解:钠、铝共融物投入一定量的水中可发生:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸体积为V2L时,溶液的溶质为NaCl和AlCl3,
A.蒸干过程氯化铝水解,得到NaCl与氢氧化铝,灼烧得到固体为NaCl、Al2O3,W2-W1为固体中O元素、Cl元素质量之和,而氯元素质量=a×V2×35.5,故35.5aV2<w2-w1,故A错误;
B.金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,联立解得n(Al)≤
mol,故B正确;
C.由2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,
n(Na)+
n(Al)=
,故n(Na)+3n(Al)=
mol,故C正确;
D.aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量,故aV2=n(Na)+3n(Al),故D正确;
故选A.
A.蒸干过程氯化铝水解,得到NaCl与氢氧化铝,灼烧得到固体为NaCl、Al2O3,W2-W1为固体中O元素、Cl元素质量之和,而氯元素质量=a×V2×35.5,故35.5aV2<w2-w1,故A错误;
B.金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,联立解得n(Al)≤
| w1 |
| 50 |
C.由2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,
| 1 |
| 2 |
| 3 |
| 2 |
| V1 |
| 22.4 |
| V1 |
| 11.2 |
D.aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量,故aV2=n(Na)+3n(Al),故D正确;
故选A.
点评:本题考查混合物的计算,难度中等,注意从守恒角度进行解答,较好的考查学生对知识应用及分析解决问题的能力.

练习册系列答案
相关题目
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
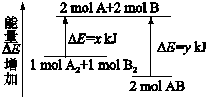

| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |
下列有关仪器使用方法或实验操作正确的是( )
| A、分液时下层液体从分液漏斗下端放出,上层液体从上口倒出 |
| B、酸碱滴定实验中,酸式滴定管装液前不必先用待装溶液润洗 |
| C、蒸馏过程中,冷却水从冷凝管的上端通入 |
| D、配制一定物质的量浓度的溶液时,直接将称取的固体药品倒入容量瓶加水溶解 |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量(mol) | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q (Q>0) |
| A、容器①、②中反应的平衡常数相等 |
| B、达平衡时,两个容器中XY3的物质的量浓度均为2 mol?L-1 |
| C、容器②中反应达到平衡时放出的热量为Q=23.15 kJ |
| D、若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ |
已知在101KPa,298K条件下,2mol氢气燃烧生成水蒸气放出483.6kJ热量,且有H2O(1)=H2O(g)△H=+44kJ?mol-1,下列热化学方程式正确的是( )
A、H2O(g)=H2(g)+
| ||
| B、2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2=2H2O(g)△H=-483.6 kJ?mol-1 |
 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |


 .请回答下列问题:
.请回答下列问题: 的化学方程式
的化学方程式