题目内容
下列离子方程式中,正确的是( )
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成氢氧化铝和氯化铵;
B.反应生成氯化钙、水、二氧化碳;
C.小苏打为碳酸氢钠,反应生成氯化钠、水、二氧化碳;
D.反应生成硝酸铜、二氧化氮和水.
B.反应生成氯化钙、水、二氧化碳;
C.小苏打为碳酸氢钠,反应生成氯化钠、水、二氧化碳;
D.反应生成硝酸铜、二氧化氮和水.
解答:
解:A.向AlCl3溶液中滴加过量的氨水的离子反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故A错误;
B.CaCO3与盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故B正确;
C.小苏打治疗胃酸过多的离子反应为HCO3-+H+=CO2↑+H2O,故C错误;
D.Cu片与浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故D错误;
故选B.
B.CaCO3与盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故B正确;
C.小苏打治疗胃酸过多的离子反应为HCO3-+H+=CO2↑+H2O,故C错误;
D.Cu片与浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
A、氮气的电子式: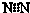 | ||
B、羟基的电子式: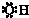 | ||
C、氯离子的结构示意图: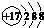 | ||
D、质子数为92、中子数为146的铀(U)原子的核素符号:
|
Se是人体必需的微量元素,下列关于
Se和
Se的说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
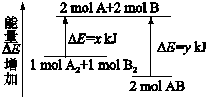

| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |
已知在101KPa,298K条件下,2mol氢气燃烧生成水蒸气放出483.6kJ热量,且有H2O(1)=H2O(g)△H=+44kJ?mol-1,下列热化学方程式正确的是( )
A、H2O(g)=H2(g)+
| ||
| B、2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2=2H2O(g)△H=-483.6 kJ?mol-1 |
