题目内容
5.氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题.表列举了不同温度下大气固氮和工业固氮的部分K值.| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
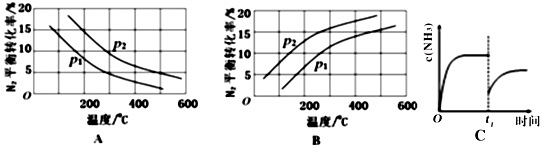
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
分析 (1)①温度越高,K越大,说明升高温度,平衡正移;
②a.增大压强,平衡不移动;
b.增大反应物的浓度,平衡正向移动,但平衡常数不变;
c.使用催化剂,平衡正向移动;
d.升高温度,平衡正向移动,平衡常数变大;
③从氮气的分子结构分析解答;
(2)①合成氨反应中,在500℃左右催化剂活性最高;
②合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;平衡常数等于平衡时生成物浓度幂之积比上反应物浓度幂之积,代入进行计算;
③由可知氨气的浓度瞬间减小,所以应是容器容积不变条件下移走适量氨气,降低氨气的浓度;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,故答案为:吸热;
②a.增大压强,平衡不移动,不符合题意,故不选;
b.增大反应物的浓度,平衡正向移动,但平衡常数不变,故选;
c.使用催化剂,平衡正向移动,不符合题意,故不选;
d.升高温度,平衡正向移动,平衡常数变大,不符合题意,故不选;
故选b;
③氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量,所以大气固氮”和“工业固氮”反应的活化能都很高,故答案为:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量;
(2)①成氨反应中,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适;
故答案为:从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;
②合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大;
N2(g)+3H2(g)?2NH3(g)
c(初) 10-3 10-3 0
c(变) 10-4 3×10-4 2×10-4
c(平) 9×10-4 7×10-4 2×10-4
,所以K=$\frac{({2×1{0}^{-4})}^{2}}{9×1{0}^{-4}×(7×1{0}^{-4})^{3}}$=1.3×l05,故答案为:A;р2>р1;1.3×l05;
③由可知氨气的浓度瞬间减小,所以应是容器容积不变条件下移走适量氨气,降低氨气的浓度,故答案为:容器容积不变条件下移走适量氨气,降低氨气的浓度;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
点评 本题考查了平衡常数的应用、合成氨反应的条件选择、影响化学平衡的因素、电解原理的应用、盖斯定律的应用等,题目难度中等,侧重于基础知识的综合应用考查,注意把握K与温度的关系以及影响化学平衡的因素.

 阅读快车系列答案
阅读快车系列答案| A. | NH4+、Al3+、NO3-、Cl- | B. | Na+、NO3-、K+、CH3COO- | ||
| C. | Na+、MnO4-、SO42-、K+ | D. | HCO3-、Cl-、K+、SO42- |
| A. | 呈弱酸性,使石蕊试液显浅红色 | |
| B. | 分子中的13个原子有可能处于同一平面 | |
| C. | 可以和NaHCO3溶液反应产生气体 | |
| D. | 能与FeCl3溶液反应生成紫色沉淀 |
| A. | 通常状况下,NA个N2所占的体积约为22.4L | |
| B. | 1L1mol•L-1NaOH水溶液中含有的氧原子数为NA | |
| C. | 足量Na与1molCl2完全反应,转移电子的数目为2NA | |
| D. | 1mol Na2O2中含有的阴离子数为2NA |
| A. | l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键 | |
| B. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| C. | lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上 | |
| D. | 80℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| A. | 青花瓷 | B. | 水泥 | C. | 石英 | D. | 玻璃 |
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 20 g氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |