题目内容
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 通常状况下,NA个N2所占的体积约为22.4L | |
| B. | 1L1mol•L-1NaOH水溶液中含有的氧原子数为NA | |
| C. | 足量Na与1molCl2完全反应,转移电子的数目为2NA | |
| D. | 1mol Na2O2中含有的阴离子数为2NA |
分析 A.通常状况下,Vm大于22.4L/mol;
B.氢氧化钠溶液中,氢氧化钠和水都含有氧原子;
C.钠与氯气反应生成氯化钠,钠足量依据氯气的物质的量计算转移电子数;
D.过氧化钠中阴离子为过氧根子.
解答 解:A.通常状况下,Vm大于22.4L/mol,则NA个N2所占的体积大于22.4L,故A错误;
B.氢氧化钠溶液中,氢氧化钠和水都含有氧原子,所以1L1mol•L-1NaOH水溶液中含有的氧原子数远远大于NA,故B错误;
C.足量Na与1molCl2完全反应生成2mol氯化钠,生成2mol氯离子,转移电子数目为2NA,故C正确;
D.过氧化钠中阴离子为过氧根子,1mol Na2O2中含有的阴离子数为NA,故D错误;
故选:C.
点评 本题考查了物质的量的有关计算,根据物质的量的有关公式进行分析解答,熟练掌握物质的量有关公式中各个物理量的关系,题目难度不大,注意气体摩尔体积使用条件和对象,注意过氧化钠结构组成.

练习册系列答案
相关题目
10.下列气体在同温度、同压强、同质量时,体积最小的是( )
| A. | CO2 | B. | CO | C. | CH4 | D. | H2 |
11. 如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
 如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 molol O2反应,则溶液中迁移0.4 mol e- | |
| C. | 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| D. | 正极区溶液的pH增大 |
8.电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3•2H2O及FeO等杂质.回收废酸同时生产含铁产品的流程如图:
已知:i.酸洗钢制构件后得到废酸的主要成分如表所示.
ii pH<4时,Fe2+不易被氧气氧化.
(1)酸洗钢制构件时发生反应的离子方程式:2H++FeO=Fe2++H2O、6H++Fe2O3•H2O+Fe═3Fe2++4H2O.
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)?FeSO4(s)+2HCl( aq).
①加入过量H2SO4的作用是抑制Fe2+水解:防止pH>4时,Fe2+被氧气氧化:同时提供H+利于HC1气体的逸出;提供SO42-利于FeSO4固体析出(至少写出两点).
②用化学平衡原理解释鼓入空气的目的:空气带走HCl气体,促进平衡FeCl2(s)+H 2SO4(aq)?FeSO4(s)+2HCl(aq)向正反应方向移动,有利于FeSO4固体的析出.
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是2FeSO4$\frac{\underline{\;焙烧\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)过程IV发生反应的离子方程式是2Fe2++H2O2+8Cl-+2H+═2FeCl4-+2H2O.
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH+X- $?_{脱附}^{吸附}$RX+OH-.当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-?Fe3++4C1-.
①吸附后溶液酸性下降的原因是利用阴离于空换树脂进行吸附时,树脂上的OH-被交换下来进入吸附后溶液.
②洗脱液中主要含有的溶质是FeCl3和HC1.

已知:i.酸洗钢制构件后得到废酸的主要成分如表所示.
| 成分 | Cl- | 游离HCl | Fe2+ | Fe3+ |
| 含量g•/L-1 | 130-160 | 50-70 | 60-80 | 0 |
(1)酸洗钢制构件时发生反应的离子方程式:2H++FeO=Fe2++H2O、6H++Fe2O3•H2O+Fe═3Fe2++4H2O.
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)?FeSO4(s)+2HCl( aq).
①加入过量H2SO4的作用是抑制Fe2+水解:防止pH>4时,Fe2+被氧气氧化:同时提供H+利于HC1气体的逸出;提供SO42-利于FeSO4固体析出(至少写出两点).
②用化学平衡原理解释鼓入空气的目的:空气带走HCl气体,促进平衡FeCl2(s)+H 2SO4(aq)?FeSO4(s)+2HCl(aq)向正反应方向移动,有利于FeSO4固体的析出.
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是2FeSO4$\frac{\underline{\;焙烧\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)过程IV发生反应的离子方程式是2Fe2++H2O2+8Cl-+2H+═2FeCl4-+2H2O.
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH+X- $?_{脱附}^{吸附}$RX+OH-.当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-?Fe3++4C1-.
①吸附后溶液酸性下降的原因是利用阴离于空换树脂进行吸附时,树脂上的OH-被交换下来进入吸附后溶液.
②洗脱液中主要含有的溶质是FeCl3和HC1.
5.氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题.表列举了不同温度下大气固氮和工业固氮的部分K值.
(1)①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
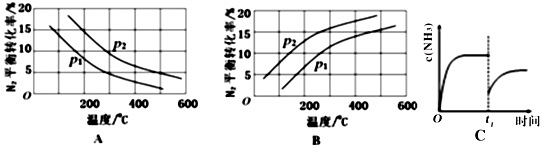
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.

②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
12.NA表示阿伏加德罗常数数值,下列有关说法正确的是( )
| A. | 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 50 mL 14.0 mol•L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA | |
| D. | 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等 |
16.下列说法正确的是( )
| A. | 水的摩尔质量是18g | B. | 1分子硫酸的质量是98g | ||
| C. | 1molN2的质量是28g | D. | 摩尔是七个基本物理量之一 |
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下44.8L乙醇(C2H5OH)含有氢原子数为12NA | |
| B. | 25°C,101KPa条件下,1.4g N2的体积大于1.12L | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和 N2的混合气体含有约3.01×1022个原子 |
 氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.