题目内容
10.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键 | |
| B. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| C. | lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上 | |
| D. | 80℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
分析 A.苯乙烯分子中,苯环不含碳碳双键,1mol苯乙烯中含有1mol碳碳双键;
B.乙醇水溶液中,乙醇分子中、水分子中都含有氢原子;
C.依据甲烷四面体结构、乙烯平面结构判断解答;
D.溶液体积未知.
解答 解:A.104g苯乙烯的物质的量为1mol,苯环中的碳碳键为独特键,不存在碳碳双键,所以1mol苯乙烯中含有1mol碳碳双键,含有的碳碳双键数为NA个,故A错误;
B.乙醇水溶液中,乙醇分子中、水分子中都含有氢原子,所以在50g质量分数为46%的乙醇水溶液中,含有氢原子数远远大于3NA,故B错误;
C.依据甲烷与乙烯分子结构可知:CH3-CH=CH-CH2-CH3中碳原子都可以在碳碳双键确定的平面上,碳碳双键上的两个氢原子一定在该平面,亚甲基中2个氢原子都不在该平面,两个甲基上各有1个氢原子可以在该平面上,所以最多有9个原子共面,则lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上,故C正确;
D.依据n=CV可知,溶液体积未知无法计算氢氧根子数目,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件,注意苯环中不含碳碳双键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.用ClO2溶液处理含NaCN的废水的反应原理为:5NaCN+2ClO2+11H2O=5NaHCO3+3NH3↑+2NH4Cl,已知HCN的酸性比H2CO3弱.下列有关说法正确的是( )
| A. | 该反应中ClO2作氧化剂,NaCN中氮元素被氧化 | |
| B. | 常温下NaHCO3的水溶液呈酸性 | |
| C. | 0.1mol/L的NaCN溶液中c(CN-)为0.1mol/L | |
| D. | 每消耗1mol ClO2,该反应转移5mole- |
1.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 容量瓶 | C. | 蒸发皿 | D. | 圆底烧瓶 |
5.氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题.表列举了不同温度下大气固氮和工业固氮的部分K值.
(1)①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
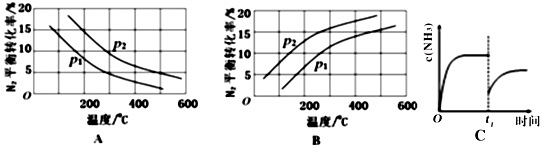
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.

②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
2.离子反应是一类重要反应,还原性Fe2+>Br-,下列有关离子方程式书写正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42═MgSO4↓+2H2O | |
| C. | 向硫酸氢钠溶液加氢氧化钡溶液至完全沉淀:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | FeBr2溶液与Cl2按照等物质的量反应:2Br-+Cl2═2Cl-+Br2 |
6.一定物质的量浓度的NaCl、MgCl2、AlCl3三种溶液与同体积同浓度的AgNO3完全反应,消耗三溶液的体积比为3:2:1,则三种溶液中Cl-的物质的量浓度之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:4 |
7.1g O2和1g O3相比,下列表述正确的是( )
| A. | 所含分子数相同 | B. | 1g O3中所含分子数较多 | ||
| C. | 所含原子数不同 | D. | 所含原子数相同 |
