题目内容
2.下列关于烷烃性质的叙述中,不正确的是( )| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |
分析 A.随着相对分子质量的增大,分子间的范德华引力增大,烷烃的熔沸点随着相对分子质量的增加而升高;
B.饱和烃不能使溴水、KMnO4溶液褪色;
C.烷烃的化学性质与CH4相似,能发生燃烧、取代反应;
D.当状态相同时,密度与相对分子质量成正比.
解答 解:A.烷烃结构相似,相对分子质量越大,分子间作用力越大,熔沸点越高,即烷烃的熔沸点随着相对分子质量的增大而升高,随着碳原子数的增加,常温下的状态逐渐由气态变化到液态、固态,故A正确;
B.烷烃的结构决定了化学性质,碳原子是饱和状态,所以均不能使溴水、酸性KMnO4溶液褪色,故B错误;
C.烷烃的特征反应为取代反应,跟卤素单质在光照条件下能发生取代反应,故C正确;
D.烷烃结构相似,相对分子质量越大,分子间作用力越大,密度越大,故D正确;
故选:B.
点评 本题考查了烷烃的结构和性质应用,根据结构决定性质,烷烃结构上有相似性,性质上也具有相似性是解答的关键,题目难度不大.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
5.氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题.表列举了不同温度下大气固氮和工业固氮的部分K值.
(1)①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
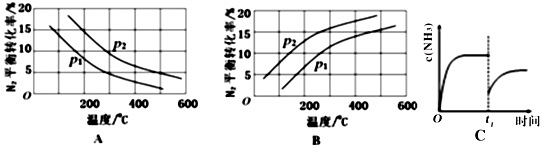
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是b.
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:氮气分子中N≡N键能很大,断开N≡N需要吸收较高能量.
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮.
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.

②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是A(填“A”或“B”);比较P1、P2的大小关系 р2>р1;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=1.3×l05 (计算结果保留2位有效数字).
③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是容器容积不变条件下移走适量氨气,降低氨气的浓度.
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:
N2(g)+3H2(g)?2NH3(g)△H1=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H2=-571.6kJ•mol-1 )
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 标准状况下,22.4L的CCl4中含有CCl4分子数目为NA | |
| C. | 25℃时,1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,转移的电子数目为0.2NA |
10.下列说法中不正确的是( )
| A. | 强酸、强碱、大多数盐是强电解质,弱酸、弱碱和水是弱电解质 | |
| B. | 电解质溶液导电性的强弱跟单位体积溶液里自由移动的离子多少有关 | |
| C. | 具有强极性共价键的化合物一定是强电解质 | |
| D. | 硫酸钠是强电解质,碳酸氢钠也是强电解质 |
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下44.8L乙醇(C2H5OH)含有氢原子数为12NA | |
| B. | 25°C,101KPa条件下,1.4g N2的体积大于1.12L | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和 N2的混合气体含有约3.01×1022个原子 |
7.1g O2和1g O3相比,下列表述正确的是( )
| A. | 所含分子数相同 | B. | 1g O3中所含分子数较多 | ||
| C. | 所含原子数不同 | D. | 所含原子数相同 |
14.在c(NaOH)=2c(NaAlO2)的溶液中滴加稀HCl,下列离子方程式正确的是( )
| A. | OH-+AlO2-+2H+=Al(OH)3 | B. | OH-+AlO2-+5H+=Al3++3H2O | ||
| C. | 2OH-+AlO2-+3H+=Al(OH)3+H2O | D. | OH-+2AlO2-+3H++H2O=2Al(OH)3 |
11.关于胶体.下列说法正确的是( )
| A. | 胶体就是直径为10-9m~10-7m的微粒 | |
| B. | 实验室制备Fe(OH)3胶体的方法是将饱和FeCl3溶液滴入NaOH溶液并加热 | |
| C. | 电解Fe(OH)3胶体,阴极附近红褐色加深,是因为胶体带正电,向阴极移动 | |
| D. | 可以用丁达尔效应来区别胶体和溶液 |
12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素,Y元素形成的化合物种类最多,Z是短周期中金属性最强的元素,W的单质是一种黄色晶体或粉末.下列说法不正确的是( )
| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |