题目内容
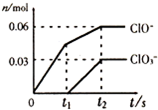 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
考点:氧化还原反应的计算,化学方程式的有关计算,氯气的化学性质
专题:图示题
分析:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,结合m=nM计算氢氧化钾质量.
解答:
解:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A正确;
B.生成ClO-和ClO3-两种离子,还生成Cl-,Cl元素的化合价既升高又降低,则氯气在反应中既是氧化剂也是还原剂,故B正确;
C.由Cl原子守恒可知,n(Cl)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则氯气的物质的量为0.15mol,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;
故选C.
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A正确;
B.生成ClO-和ClO3-两种离子,还生成Cl-,Cl元素的化合价既升高又降低,则氯气在反应中既是氧化剂也是还原剂,故B正确;
C.由Cl原子守恒可知,n(Cl)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则氯气的物质的量为0.15mol,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;
故选C.
点评:本题考查了氧化还原反应的计算,为高频考点,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子化合物中,都由与Ar电子层结构相同的离子组成的是( )
| A、HBr |
| B、CCl4 |
| C、NaCl |
| D、KCl |
在一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A、单位时间内生成nmol A2,同时生成nmol AB |
| B、容器内总压强不随时间改变 |
| C、单位时间内生成2nmol AB同时生成nmol B2 |
| D、任何时间内A2、B2的物质的量之比为定值 |
某温度下,将Cl2通入NaOH 溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-、ClO3-的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、3:1 | D、4:1 |
下列解释实验事实的离子方程式不正确的是( )
| A、Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ |
| B、稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ |
| C、用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
下列有关Cl、N、S、C等非金属元素化合物的说法正确的是( )
| A、实验室制氯气产生的尾气可用澄清石灰水吸收 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、实验室可用浓硫酸干燥氨气 |
| D、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下: