题目内容
下列离子化合物中,都由与Ar电子层结构相同的离子组成的是( )
| A、HBr |
| B、CCl4 |
| C、NaCl |
| D、KCl |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:与Ar原子具有相同的电子层结构的离子是含有18电子的微粒,其中一种是阳离子一种是阴离子.
解答:
解:A、HBr是共价化合物,分子中不存在离子,故A错误;
B、CCl4是共价化合物,分子中不存在离子,故B错误;
C、钠离子是10电子的阳离子,氯离子是18电子的阴离子,不符合题意,故C错误;
D、钾离子是18电子的阳离子,氯离子是18电子的阴离子,都由与Ar电子层结构相同的离子组成的,故D正确.
故选D.
B、CCl4是共价化合物,分子中不存在离子,故B错误;
C、钠离子是10电子的阳离子,氯离子是18电子的阴离子,不符合题意,故C错误;
D、钾离子是18电子的阳离子,氯离子是18电子的阴离子,都由与Ar电子层结构相同的离子组成的,故D正确.
故选D.
点评:本题考查学生有关原子核外电子排布的知识,可以根据核外电子排布来分析,题目难度不大.

练习册系列答案
相关题目
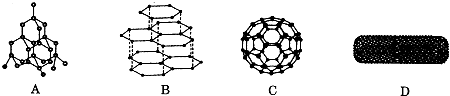
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
X、Y、Z三种元素在周期表中,X、Y同主族,Y和Z同周期,它们的原子的最外层电子数之和为16,则这三种元素可能是( )
| A、Na、K、Ca |
| B、N、P、S |
| C、F、Cl、S |
| D、O、S、Cl |
某元素气态氢化物的化学式为XH3,则此元素最高价氧化物对应的水化物的化学式应是( )
| A、HXO4 |
| B、H2XO3 |
| C、H2XO4 |
| D、H3XO4 |
在一密闭容器中,反应3A(g)+B(s)?2C(g)+2D(g)△H>0达到平衡后,改变以下条件,下列说法正确的是( )
| A、增大压强,正、逆反应速率同等程度增大,平衡不移动 |
| B、升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动 |
| C、增加A的浓度,平衡向正方向移动,平衡常数增大 |
| D、增加B的用量,正、逆反应速率不变,平衡不移动 |

 、
、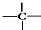 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如: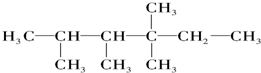 分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.
分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.