题目内容
下列解释实验事实的离子方程式不正确的是( )
| A、Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ |
| B、稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ |
| C、用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.Cu与浓H2SO4反应生成硫酸铜、二氧化硫、水;
B.氯化钡是可溶性的钡盐,硫酸是强酸,二者之间反应仅有难电离物质硫酸钡沉淀生成;
C.只有盐酸和氯化钙可拆;
D.反应生成硅酸钠,具有粘合性.
B.氯化钡是可溶性的钡盐,硫酸是强酸,二者之间反应仅有难电离物质硫酸钡沉淀生成;
C.只有盐酸和氯化钙可拆;
D.反应生成硅酸钠,具有粘合性.
解答:
解:A.Cu与浓H2SO4反应生成硫酸铜、二氧化硫、水,化学方程式为:Cu+2H2SO4(浓)
Cu2++SO42-+SO2↑+2H2O,在浓硫酸中硫酸主要以分子形式存在,此反应一般不写离子方程式,故A错误;
B.氯化钡是可溶性的钡盐,硫酸是强酸,二者之间反应仅有难电离物质硫酸钡沉淀生成,符合题意要求,故B正确;
C.用大理石与稀盐酸制备CO2的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O,其中只有盐酸和氯化钙属于可溶性的强电解质,可拆,故C正确;
D.SiO2+2NaOH═Na2SiO3+H2O,反应生成硅酸钠,具有粘合性,则盛放烧碱的试剂瓶不能用玻璃塞,故D正确;
故选:A.
| ||
B.氯化钡是可溶性的钡盐,硫酸是强酸,二者之间反应仅有难电离物质硫酸钡沉淀生成,符合题意要求,故B正确;
C.用大理石与稀盐酸制备CO2的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O,其中只有盐酸和氯化钙属于可溶性的强电解质,可拆,故C正确;
D.SiO2+2NaOH═Na2SiO3+H2O,反应生成硅酸钠,具有粘合性,则盛放烧碱的试剂瓶不能用玻璃塞,故D正确;
故选:A.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
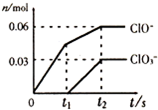 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出如图四个气球,其中气体为CH4的是( ) 

| A、图中A为CH4、B为CO2 |
| B、图中A为SO2、C为O2 |
| C、图中B为CO2、D为CH4 |
| D、图中C为CH4、D为O2 |
某元素气态氢化物的化学式为XH3,则此元素最高价氧化物对应的水化物的化学式应是( )
| A、HXO4 |
| B、H2XO3 |
| C、H2XO4 |
| D、H3XO4 |
R元素的原子,其最外层电子数是次外层的电子数的2倍,则R是( )
| A、S | B、Si | C、Na | D、C |
化学与科技、社会、生活有着密切的联系,下列有关说法正确的是( )
| A、乙醇汽油可用普通汽油与燃料乙醇调和而成.乙醇和汽油都是可再生能源,应大力推广乙醇汽油 |
| B、区分蛋白质胶体和葡萄糖溶液可利用丁达尔效应 |
| C、奥运场馆鸟巢使用了钒氮合金高新钢,这种新型钢材的熔点、硬度均比纯铁高 |
| D、可吸入颗粒物中含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )


| A、该固体粉末中一定不含有BaCl2 |
| B、该固体粉末中一定含有KNO3 |
| C、它的组成可能是CaCO3、BaCl2 |
| D、它的组成可能是CaCO3、Na2SO4、KNO3 |
加热N2O5时,发生以下两个反应:N2O5?N2O3+O2,N2O3?N2O+O2.在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol/L,c(N2O3) 为1.62mol/L,则c(N2O5) 为( )
| A、1.44mol/L |
| B、3.48mol/L |
| C、0.94mol/L |
| D、1.98mol/L |