题目内容
下列有关Cl、N、S、C等非金属元素化合物的说法正确的是( )
| A、实验室制氯气产生的尾气可用澄清石灰水吸收 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、实验室可用浓硫酸干燥氨气 |
| D、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题,元素及其化合物
分析:A、氯气能与水、碱发生化学反应,利用吸收尾气的效果来分析解答;
B、氢氧化钠和酸性气体NO2和HCl之间可以反应;
C、浓硫酸具有酸性,氨气是一种碱性气体;
D、金刚石是碳元素的一种同素异形体,碳单质都可以和氧气之间反应.
B、氢氧化钠和酸性气体NO2和HCl之间可以反应;
C、浓硫酸具有酸性,氨气是一种碱性气体;
D、金刚石是碳元素的一种同素异形体,碳单质都可以和氧气之间反应.
解答:
解:A、氯气能与饱和石灰水反应,但相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,其吸收效果不如烧碱溶液,所以实验室制氯气产生的尾气可用氢氧化钠溶液吸收,故A错误;
B、NaOH溶液可以和NO2反应生成硝酸钠、亚硝酸钠的溶液,和HCl反应可以得到氯化钠溶液,所以可用NaOH溶液处理NO2和HCl废气,故B正确;
C、浓硫酸具有酸性,氨气是一种碱性气体,二者间会反应,实验室不可用浓硫酸干燥氨气,应该用碱石灰,故C错误;
D、金刚石的硬度很大,能与足量氧气发生反应生成二氧化碳,故D错误.
故选B.
B、NaOH溶液可以和NO2反应生成硝酸钠、亚硝酸钠的溶液,和HCl反应可以得到氯化钠溶液,所以可用NaOH溶液处理NO2和HCl废气,故B正确;
C、浓硫酸具有酸性,氨气是一种碱性气体,二者间会反应,实验室不可用浓硫酸干燥氨气,应该用碱石灰,故C错误;
D、金刚石的硬度很大,能与足量氧气发生反应生成二氧化碳,故D错误.
故选B.
点评:本题综合考查学生元素以及化合物的性质知识,注意知识的迁移和应用以及教材知识的熟练记忆是重点,难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
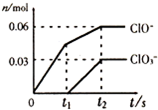 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
化学与科技、社会、生活有着密切的联系,下列有关说法正确的是( )
| A、乙醇汽油可用普通汽油与燃料乙醇调和而成.乙醇和汽油都是可再生能源,应大力推广乙醇汽油 |
| B、区分蛋白质胶体和葡萄糖溶液可利用丁达尔效应 |
| C、奥运场馆鸟巢使用了钒氮合金高新钢,这种新型钢材的熔点、硬度均比纯铁高 |
| D、可吸入颗粒物中含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )


| A、该固体粉末中一定不含有BaCl2 |
| B、该固体粉末中一定含有KNO3 |
| C、它的组成可能是CaCO3、BaCl2 |
| D、它的组成可能是CaCO3、Na2SO4、KNO3 |
在一密闭容器中,反应3A(g)+B(s)?2C(g)+2D(g)△H>0达到平衡后,改变以下条件,下列说法正确的是( )
| A、增大压强,正、逆反应速率同等程度增大,平衡不移动 |
| B、升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动 |
| C、增加A的浓度,平衡向正方向移动,平衡常数增大 |
| D、增加B的用量,正、逆反应速率不变,平衡不移动 |
常温下pH=3的盐酸与pH=9的NaOH溶液等体积混合(假设体积等于混合前两溶液体积和),混合溶液中c(H+)的计算式是( )
A、
| ||
B、
| ||
C、
| ||
| D、以上计算式都不对 |
某元素原子价电子构型3d104S2,其应在( )
| A、第四周期ⅡA族 |
| B、第四周期ⅡB族 |
| C、第四周期ⅦA族 |
| D、第四周期ⅦB族 |
加热N2O5时,发生以下两个反应:N2O5?N2O3+O2,N2O3?N2O+O2.在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol/L,c(N2O3) 为1.62mol/L,则c(N2O5) 为( )
| A、1.44mol/L |
| B、3.48mol/L |
| C、0.94mol/L |
| D、1.98mol/L |
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A、
| ||
B、
| ||
| C、c(H+)和c(OH-)的乘积 | ||
| D、OH-的物质的量 |