题目内容
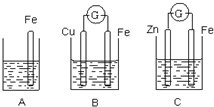 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)A中反应的离子方程式为
(2)C中被腐蚀的金属是
(3)A、B、C中铁被腐蚀的速率,由大到小的顺序是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)铁与硫酸发生置换反应;铁做负极,铜做正极,电解质溶液为硫酸,则正极反应为2H++2e-=H2↑;
(2)锌比铁活泼,做原电池的负极而被氧化,阳离子向正极移动;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
(2)锌比铁活泼,做原电池的负极而被氧化,阳离子向正极移动;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答:
解:(1)A中B中铁与硫酸发生置换反应生成氢气,其反应的离子方程式为Fe+2H+=Fe2++H2↑;铁做负极,铜做正极,电解质溶液为硫酸,则正极反应为2H++2e-=H2↑,
故答案为:Fe+2H+=Fe2++H2↑;2H++2e-=H2↑;
(2)C形成原电池,锌比铁活泼,做原电池的负极而被氧化,溶液中阳离子向正极移动,即从左向右移动,
故答案为:Zn;从左向右;
(3)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,
故答案为:B>A>C.
故答案为:Fe+2H+=Fe2++H2↑;2H++2e-=H2↑;
(2)C形成原电池,锌比铁活泼,做原电池的负极而被氧化,溶液中阳离子向正极移动,即从左向右移动,
故答案为:Zn;从左向右;
(3)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,
故答案为:B>A>C.
点评:本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A、离O点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 |
| C、B元素是图中金属性最强的元素 |
| D、B、C最高价氧化物的水化物可以相互反应 |
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示. 某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是
某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是