题目内容
1.15g金属钠跟水反应后,得到100mL溶液,试计算:(已知方程式2Na+2H2O=2NaOH+H2↑)
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液中溶质的物质的量浓度是多少?
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液中溶质的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算Na的物质的量,根据方程式2Na+2H2O=2NaOH+H2↑,计算氢气、氢氧化钠物质的量,根据V=nVm计算氢气体积,根据c=
计算氢氧化钠溶液物质的量的浓度.
| m |
| M |
| n |
| V |
解答:
解:1.15gNa 的物质的量=
=0.05mol
2 Na+2 H2O═2NaOH+H2↑
2 2 1
0.05mol n(NaOH) n(H2)
n(H2)=
n(Na)=0.025 mol
n(NaOH)=n(Na)=0.05 mol
(1)标况下,V(H2)=0.025mol×22400mL/mol=560mL
答:生成氢气的体积为560mL.
(2)c(NaOH)=
=0.5 mol/L
答:所得氢氧化钠溶液的浓度为0.5mol/L.
| 1.15g |
| 23g/mol |
2 Na+2 H2O═2NaOH+H2↑
2 2 1
0.05mol n(NaOH) n(H2)
n(H2)=
| 1 |
| 2 |
n(NaOH)=n(Na)=0.05 mol
(1)标况下,V(H2)=0.025mol×22400mL/mol=560mL
答:生成氢气的体积为560mL.
(2)c(NaOH)=
| 0.05mol |
| 0.1L |
答:所得氢氧化钠溶液的浓度为0.5mol/L.
点评:本题考查化学方程式有关计算,比较基础,注意理解化学方程式表示的意义,有利于基础知识的巩固.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾.从开始通电时,收集B和C逸出的气体.1min后测得B口的气体体积为C口处的一半,下列说法不正确的是( )

| A、电源左极为正极 |
| B、电解槽左侧的电极反应方程式为:2H2O-4e-═O2+4H+ |
| C、D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大 |
| D、在标准状况下,若1min后从C口处收集到的气体比B口处收集到的气体多2.24L,则有0.1NA个SO42-通过阴离子膜 |
电浮选凝聚法处理酸性污水的工作原理如图.下列说法不正确的是( )

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
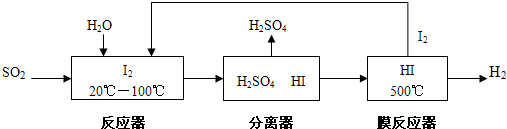
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
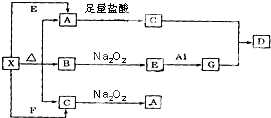 如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.
如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.
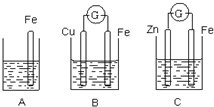 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸. 如图所示装置:
如图所示装置: