题目内容
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2
| ||
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据电子流动方向知,Ag作负极、石墨作正极,含有盐桥的原电池放电时,盐桥中阴离子向负极移动、阳离子向正极移动,正极上铁离子得电子发生还原反应,其电池反应实际上为Ag和铁离子的氧化还原反应;
(2)燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,碱性条件下,氨气失电子和氢氧根离子反应生成氮气和水.
(2)燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,碱性条件下,氨气失电子和氢氧根离子反应生成氮气和水.
解答:
解:(1)根据电子流动方向知,Ag作负极、石墨作正极,含有盐桥的原电池放电时,盐桥中阴离子向负极移动、阳离子向正极移动,即阴离子向AgNO3溶液移动,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+,其电池反应实际上为Ag和铁离子的氧化还原反应,所以电池反应式为Fe3++Ag═Fe2++Ag+;
故答案为:AgNO3;Fe3++e-=Fe2+;Fe3++Ag═Fe2++Ag+;
(2)燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以通入氨气的电极为负极、通入氧气的电极为正极,碱性条件下,氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:负极;2NH3+6OH--6e-=N2+6H2O.
故答案为:AgNO3;Fe3++e-=Fe2+;Fe3++Ag═Fe2++Ag+;
(2)燃料电池中,通入燃料的电极为负极、通入氧化剂的电极为正极,所以通入氨气的电极为负极、通入氧气的电极为正极,碱性条件下,氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:负极;2NH3+6OH--6e-=N2+6H2O.
点评:本题考查了原电池原理,明确原电池中电子流向与正负极的关系、正负极上发生的电极反应即可解答,难点是电极反应式的书写,对于燃料电池反应式的书写,先结合电解质溶液酸碱性书写正极反应式,用总反应式减去正极反应式即得负极反应式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
“化学是一门中心学科,与社会、生活有密切的关系”.下列叙述中正确的是( )
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
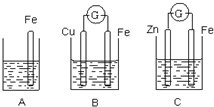 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.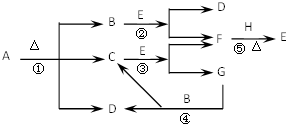 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.