题目内容
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A、离O点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 |
| C、B元素是图中金属性最强的元素 |
| D、B、C最高价氧化物的水化物可以相互反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:O点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,C为Al元素,根据元素的种类可知虚线相连的元素处于同一族,结合对应元素的性质解答该题.
解答:
解:A.离O点越远的元素原子的核电荷数增大,若电子层相同,半径越小,故A错误;
B.由原子序数可知,虚线相连的元素处于同一族,A为O元素,元素位于元素周期表ⅥA族,故B正确;
C.B为Na元素,是图中金属性最强的元素,故C正确;
D.B、C最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,故D正确,
故选A.
B.由原子序数可知,虚线相连的元素处于同一族,A为O元素,元素位于元素周期表ⅥA族,故B正确;
C.B为Na元素,是图中金属性最强的元素,故C正确;
D.B、C最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,故D正确,
故选A.
点评:本题考查元素周期表、元素周期律等,难度不大,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式正确的是( )
| A、Na2S溶液中滴入酚酞呈现红色:S2-+2H2O?H2S+2OH- | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、醋酸溶解含碳酸钙的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾.从开始通电时,收集B和C逸出的气体.1min后测得B口的气体体积为C口处的一半,下列说法不正确的是( )

| A、电源左极为正极 |
| B、电解槽左侧的电极反应方程式为:2H2O-4e-═O2+4H+ |
| C、D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大 |
| D、在标准状况下,若1min后从C口处收集到的气体比B口处收集到的气体多2.24L,则有0.1NA个SO42-通过阴离子膜 |
“化学是一门中心学科,与社会、生活有密切的关系”.下列叙述中正确的是( )
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
下列离子方程式书写错误的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、Ca(OH)2溶液中通入足量的CO2:CO2+OH-=HCO3- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
下列各组离子在指定溶液中,能大量共存的是( )
| A、强碱性溶液中:K+,ClO-,Ba2+,Cl- |
| B、水电离c(H+)═10-12mol?L-1的溶液中:Cl-,CO32-,NO3-,NH4+ |
| C、使甲基橙变红的溶液中:Fe2+,MnO4-,NO3-,Na+ |
| D、中性溶液中:Al3+,NO3-,Cl-,S2- |
电浮选凝聚法处理酸性污水的工作原理如图.下列说法不正确的是( )

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
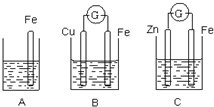 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.