题目内容
在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HN03(稀)═3Cu(NO3)2+2NO↑+4H20
在3.84g Cu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度(请写出计算过程).
在3.84g Cu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度(请写出计算过程).
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算3.84gCu的物质的量,根据方程式计算HNO3、NO的物质的量,再根据V=nVm计算NO的体积,根据c=
计算稀硝酸的物质的量的浓度.
| m |
| M |
| n |
| V |
解答:
解:3.84g Cu的物质的量=
=0.06mol,
设生成NO物质的量为x,硝酸物质的量为y,则
3 Cu+8 HNO3(稀)═3 Cu(NO3)2+2 NO↑+4H2O
3 8 2
0.06mol y x
所以x=
=0.04mol y=
=0.16mol
故标况下生成NO的体积=0.04mol×22.4L/mol=0.896L,
稀硝酸的物质的量浓度=
=1.6mol/L,
答:生成NO在标准状况下的体积为0.896L,反应前稀HNO3溶液中溶质的物质的量浓度是1.6mol/L.
| 3.84g |
| 64g/mol |
设生成NO物质的量为x,硝酸物质的量为y,则
3 Cu+8 HNO3(稀)═3 Cu(NO3)2+2 NO↑+4H2O
3 8 2
0.06mol y x
所以x=
| 0.06mol×2 |
| 3 |
| 0.06mol×8 |
| 3 |
故标况下生成NO的体积=0.04mol×22.4L/mol=0.896L,
稀硝酸的物质的量浓度=
| 0.16mol |
| 0.1L |
答:生成NO在标准状况下的体积为0.896L,反应前稀HNO3溶液中溶质的物质的量浓度是1.6mol/L.
点评:本题考查化学方程式的有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在指定溶液中,能大量共存的是( )
| A、强碱性溶液中:K+,ClO-,Ba2+,Cl- |
| B、水电离c(H+)═10-12mol?L-1的溶液中:Cl-,CO32-,NO3-,NH4+ |
| C、使甲基橙变红的溶液中:Fe2+,MnO4-,NO3-,Na+ |
| D、中性溶液中:Al3+,NO3-,Cl-,S2- |
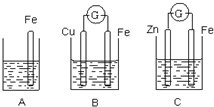 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.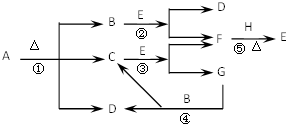 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.