题目内容
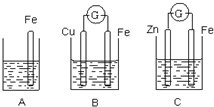
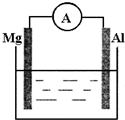
 某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是
某化学兴趣小组的同学用以下装置研究电化学的问题.甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是A.锌片溶解了32.5g B.锌片增重32.5g
C.铜片上析出1g H2 D.铜片上析1molH2.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+、正极电极反应式为2H++2e-=H2↑,根据正负极反应式进行有关计算.
解答:
解:该原电池中Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+、正极电极反应式为2H++2e-=H2↑,得失电子相同时,将正负极电极反应式相加得电池反应式为Zn+2H+=Zn2++H2↑,当有1mol电子通过时,负极上溶解m(Zn)=
×65g/mol=32.5g,正极上析出m(H2)=
×2g/mol=1g,故选AC;
故答案为:Cu;Zn+2H+=Zn2++H2↑;AC.
| 1mol |
| 2 |
| 1mol |
| 2 |
故答案为:Cu;Zn+2H+=Zn2++H2↑;AC.
点评:本题考查了原电池原理,知道正负极的判断方法及正负极上发生的反应即可解答,注意:只有得失电子相同时正负极电极反应式相加才能得到电池反应式,否则得不到电池反应式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.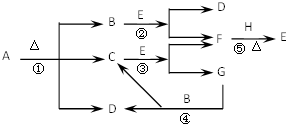 已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.
已知化合物A、D、E、G进行焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多.A~H各物质的变化关系如图所示.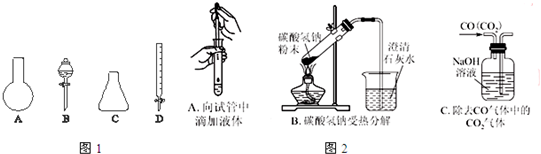
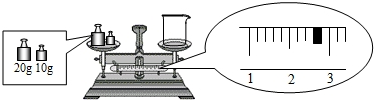
 如图所示装置:
如图所示装置: