题目内容
12.下列关于碱金属的叙述中,正确的是( )| A. | 碱金属中密度最小,熔、沸点最高的是铯 | |
| B. | 钠离子核外电子数比钠原子核外电子数少 | |
| C. | 碱金属单质都可保存在煤油中 | |
| D. | 金属钠着火时,可用水或泡沫灭火器灭火 |
分析 A.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势;
B.钠原子失去一个电子生成钠离子;
C.Li密度小于煤油;
D.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应;
解答 解:A.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势,所以从Li到Cs中,Cs密度最大、熔沸点最低,故A错误;
B.钠原子失去一个电子生成钠离子,所以钠离子核外电子数比钠原子核外电子数少1个,故B正确;
C.Li密度小于煤油,所以Li不能保存在煤油中,故C错误;
D.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应生成氧气,从而促进钠的燃烧,所以金属钠着火时,不可用水或泡沫灭火器灭火,应该用沙土覆盖,故D错误;
故选:B.
点评 本题考查碱金属族元素性质递变规律,为高考高频点,熟悉元素周期表结构、同一主族元素性质递变规律即可解答,注意碱金属保存、注意钠着火的灭火方法,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
20.下列化学用语正确的是( )
| A. | 钾原子的结构示意图为 | B. | 水分子的结构式:H-O-H | ||
| C. | NH3的电子式为 | D. | NaOH的电子式为Na+[OH]- |
17.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
4.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298.以下叙述不正确的是( )
| A. | 该元素属于第七周期 | |
| B. | 该元素位于ⅢA 族 | |
| C. | 该元素为金属元素,性质与Pb相似 | |
| D. | 该同位家原子含有114个电子,184个中子 |
1.某有机物分子中含n1个-CH2-,n2个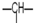 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )
 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料. ;
; ;
; ;
;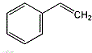 .
. :2,2,4三甲基-戊烷;
:2,2,4三甲基-戊烷; :间甲基苯乙烯.
:间甲基苯乙烯.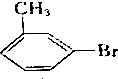 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: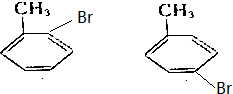 .
.