题目内容
3.用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
分析 (1)实验要求控制KMnO4溶液初始浓度相同,根据总体积为100mL,计算水的体积;
(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水;
(3)实验①和②只有pH不同,其它条件都相同;
(4)控制其他反应条件与实验①相同,加硫酸锰进行对比实验;
(5)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;根据称量固体用天平、配制溶液用容量瓶、量取液体用滴定管分析.
解答 解:(1)实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为50mL,总体积为100mL,则水的体积10mL,故答案为:50;10;
(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水,其反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(3)实验①和②只有pH不同,其它条件都相同,而且t1<t2,说明溶液的pH对该反应的速率有影响,故答案为:溶液的pH对该反应的速率有影响;
(4)控制其他反应条件与实验①相同,加硫酸锰进行对比实验,若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用);
故答案为:往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验;
(5)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液呈浅红色,红色30s内不褪去,说明滴定到终点;
称量固体用托盘天平、配制250ml溶液用250mL容量瓶、量取KMnO4溶液和草酸溶液用到酸式滴定管;
故答案为:加入最后一滴KMnO4溶液,溶液呈浅红色,且30s内不褪去;托盘天平、250mL容量瓶、(酸式)滴定管.
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意掌握温度、浓度、催化剂对化学反应速率的影响,在用对照试验来探究外界条件对反应速率的影响时,必须保证其他影响反应速率的条件一致.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案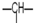 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能与Cl2发生加成反应 |
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C3H6 |
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol•L-1硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
乙同学侧定溶液pH
用pH试纸分别测定0.1 mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠
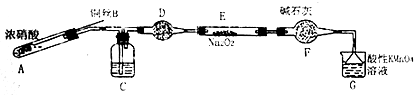
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+•
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形
瓶中,用0.1000mol/L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69%.
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有碳原子不可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 碳原子同一平面上至少有9个 | D. | 所有原子可能在同一平面上 |
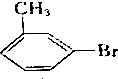 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: .
.