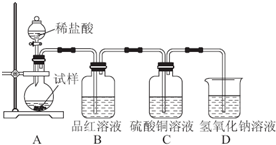
题目内容
10.硝酸甘油(三硝酸甘油脂)是临床上常用的抗心率失常药.该药可以丙烯为原料合成制得,其合成步骤如下:1-丙醇$\stackrel{①}{→}$丙烯$\stackrel{②}{→}$A $\stackrel{③}{→}$1,2,3-三氯丙烷(C1CH2CHClCH2Cl)$\stackrel{④}{→}$ B $\stackrel{⑤}{→}$三硝酸甘油脂.
(提示:CH2═CHCH3+Cl2$\stackrel{500℃}{→}$CH2═CHCH2Cl+HCl)请你写出反应②④的产物及①②③④⑤各步变化的化学方程式.如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度有何影响?请简要说明理由.
分析 1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),由信息可知,丙烯在加热条件下发生取代反应生成A为CH2═CHCH2Cl,A与氯气发生加成反应可生成ClCH2CHClCH2Cl,ClCH2CHClCH2Cl在碱性条件下水解生成B为 ,B与硝酸发生酯化反应可生成三硝酸甘油酯,据此解答.
,B与硝酸发生酯化反应可生成三硝酸甘油酯,据此解答.
解答 解:1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),由信息可知,丙烯在加热条件下发生取代反应生成A为CH2═CHCH2Cl,A与氯气发生加成反应可生成ClCH2CHClCH2Cl,ClCH2CHClCH2Cl在碱性条件下水解生成B为 ,B与硝酸发生酯化反应可生成三硝酸甘油酯.
,B与硝酸发生酯化反应可生成三硝酸甘油酯.
(1)①为1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),化学反应方程式为CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,
②为丙烯(CH3CH=CH2)在加热条件下发生取代反应生成CH2═CHCH2Cl,化学反应方程式为CH2═CHCH3+Cl2$\stackrel{500℃}{→}$CH2═CHCH2Cl+HCl,
③为CH2═CHCH2Cl与氯气发生加成反应可生成ClCH2CHClCH2Cl,化学反应方程式为CH2═CHCH2Cl+Cl2→ClCH2CHClCH2Cl,
④为ClCH2CHClCH2Cl在碱性条件下水解生成 ,化学方程式为ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl,
,化学方程式为ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl,
⑤为甘油与硝酸发生酯化反应,反应方程式为: ;
;
如果所用1-丙醇中混有2-丙醇,发生消去反应都生成丙烯,对生成物的纯度没有影响,
答:②的产物为CH2═CHCH2Cl,④的产物为 ;
;
①②③④⑤各步变化的化学方程式分别为:
CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,
CH2═CHCH3+Cl2$\stackrel{500℃}{→}$CH2═CHCH2Cl+HCl,
CH2═CHCH2Cl+Cl2→ClCH2CHClCH2Cl,
ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl, ;
;
无影响,1-丙醇中和2-丙醇都发生消去反应生成丙烯.
点评 本题考查有机物的合成与推断、有机反应方程式书写等,综合考查学生的分析能力和化学知识的综合运用能力,难度不大.

| A. | 钾原子的结构示意图为 | B. | 水分子的结构式:H-O-H | ||
| C. | NH3的电子式为 | D. | NaOH的电子式为Na+[OH]- |
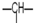 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变.
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能与Cl2发生加成反应 |
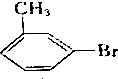 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: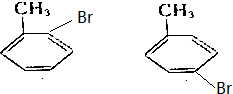 .
.