题目内容
16.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
分析 根据该元素所在的周期和族可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素,据此结合元素周期律知识进行解答.
解答 解:根据该元素所在的周期和族可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素,
(1)其中原子半径最小的是周期数最少的氢元素,没有正化合价的是非金属性最强的氧和氟元素,故答案为:H;O、F;
(2)在①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素中非金属元素有 8种,非金属性最强的是F元素,故答案为:8;F:
(3)其中气态氢化物溶于水呈碱性的是氮元素形成的氨气,其气态氢化物的化学式是NH3,故答案为:N;NH3;
(4)其中最高价氧化物对应水化物碱性最强的是金属性最强的钠元素,其最高价氧化物对应水物化学式是NaOH,氢氧化钠中含有的化学键类型是离子键和共价键,故答案为:Na;NaOH;离子键和共价键;
(5)氯元素最高正价含氧酸是高氯酸,高氯酸中只具有共价键,故答案为:共价.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度不大,熟练掌握元素周期表结构、元素周期律的内容即可解答,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
4.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298.以下叙述不正确的是( )
| A. | 该元素属于第七周期 | |
| B. | 该元素位于ⅢA 族 | |
| C. | 该元素为金属元素,性质与Pb相似 | |
| D. | 该同位家原子含有114个电子,184个中子 |
11.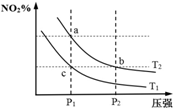 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | b、c两点的反应速率:v(b)>v(c) | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | a、b两点的平衡常数:Kb>Ka |
1.某有机物分子中含n1个-CH2-,n2个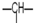 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )
 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
8.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
5.下列各组物质只用一种试剂就可以鉴别的是( )
| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
6.在同温同压下,10ml某气态烃在50mLO2里充分燃烧,得到液态水和体积为35ml混合气体,该烃的分子式可能为( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C3H6 |
 :2,2,4三甲基-戊烷;
:2,2,4三甲基-戊烷; :间甲基苯乙烯.
:间甲基苯乙烯.