题目内容
11. 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).(1)①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1、K2、K3之间的关系为$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl-N=O);
| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
(3)300℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系
如图A:
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol•L-1•min-1
③T2时该反应的平衡常数K=2.
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;
(3)将$\frac{②}{①}$得n,将n代入①中得k;
(4)①由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),结合速率之比等于化学计量数之比计算;
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
结合平衡浓度计算该反应的平衡常数K;
(5)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当$\frac{n(NO)}{n(C{1}_{2})}$=1.5时产物的含量减大.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),则平衡常数K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$,
故答案为:K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,
故答案为:289-2a;
(3)$\frac{1.44×1{0}^{-7}}{3.6×1{0}^{-8}}$=$\frac{k(0.60)^{n}}{k(0.30)^{n}}$,n=2,将n代入①中得k=$\frac{3.6×1{0}^{-8}}{(0.30)^{2}}$mol-1•L•s-1=4.0×10-7 mol-1•L•s-1,
故答案为:2;4.0×10-7 mol-1•L•s-1;
(4)①根据图象可知T1<T2,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0,
故答案为:<;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),
则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K=$\frac{{1}^{2}}{{1}^{2}×0.5}$=2,
故答案为:2;
(5)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当$\frac{n(NO)}{n(C{1}_{2})}$=1.5时产物的含量增大,所以应该是D点;
故答案为:A、D.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断及计算能力,利用三段式法进行有关计算,注意(4)中当n(NO)/n(Cl2)=2时反应物的转化率相等且产物的含量最大,题目难度中等.

| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2) (填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.

Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知如表数据
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热蒸发、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$ (用含m、n的代数式表示).
| A. | 5.6g铁与稀硝酸完全反应,转移的电子数为0.2NA | |
| B. | 标准状况下,22.4L氢气和22.4L氦气所含的质子数均为0.2NA | |
| C. | 100mL2mol•L-1 碳酸钠溶液中,CO32-数为0.2NA | |
| D. | 标准状况下,22.4LSO3所含原子数为3 NA |
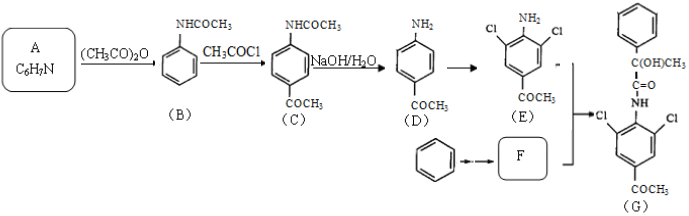 已知:
已知: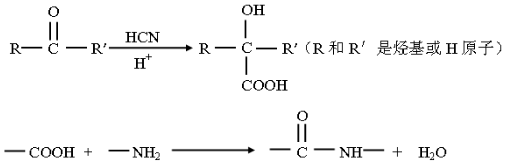
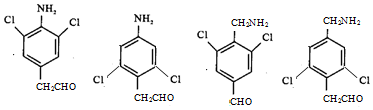
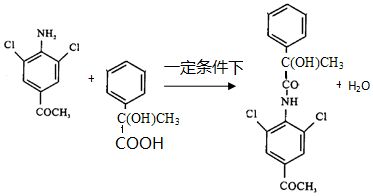
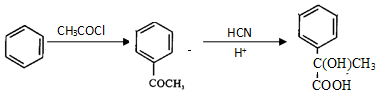 .
. (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.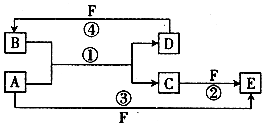 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.