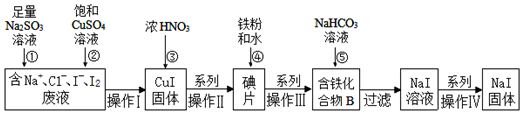
题目内容
2.以下各溶液中Cl-物质的量浓度与300mL1mol•L-1NaCl溶液中Cl-物质的量浓度相同的是( )| A. | 100mL 1mol/LAlCl3溶液 | B. | 200 mL 1mol/LMgCl2溶液 | ||
| C. | 100mL 0.5mol/LCaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
分析 根据300ml 1mol/L的NaCl溶液中Cl-的物质的量浓度为1mol/L,与溶液的体积无关,以此来分析.
解答 解:由NaCl═Na++Cl-知1 mol/L NaCl溶液中,c(Cl-)=1 mol/L,
A、1 mol/LAlCl3溶液中c(Cl-)为3 mol/L,故A不符合;
B、1 mol/L MgCl2溶液中c(Cl-)为2 mol/L,故B不符合;
C、0.5 mol/L CaCl2溶液中c(Cl-)=1 mol/L,故C符合;
D、2 mol/L KCl溶液中c(Cl-)为2 mol/L,故D不符合;
故选C.
点评 本题考查物质的量浓度的计算,明确浓度与物质的构成的关系是解答本题的关键,并注意离子的浓度与物质的浓度有关,而与溶液的体积无关,题目难度不大.

练习册系列答案
相关题目
12.乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol.
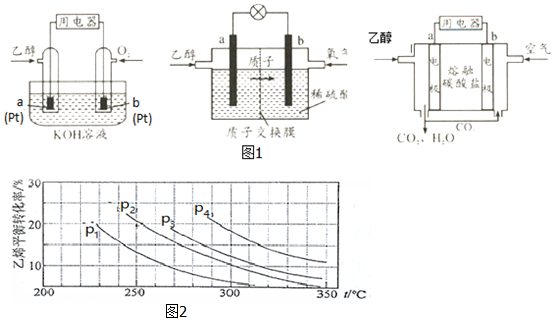
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣.现有以下三种乙醇燃料电池(图1).碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为O2.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为C2H5OH+16OH--12e-2CO32-+11H2O,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为3O2+12H++12e-6H2O,通过质子交换膜的离子是H+.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极a(填“a”或“b”)移动,电极b上发生的电极反应式为O2+2CO2+4e-2CO32-.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)?CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是:反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去、增加nH2O:nC2H4比.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是检验反应后溶液中是否还含有溴单质.
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应.
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):取含amolBr2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=amol则发生取代反应;若n(Br-)=2amol则发生氧化反应;若amol<n(Br-)<2amol则既发生了取代反应也发生了氧化反应.
Ⅰ.乙醇可以作为燃料燃烧.
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量.应用表中数据(25℃、101kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol.
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(1)三种乙醇燃料电池中正极反应物均为O2.
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为C2H5OH+16OH--12e-2CO32-+11H2O,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH.
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为3O2+12H++12e-6H2O,通过质子交换膜的离子是H+.
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极a(填“a”或“b”)移动,电极b上发生的电极反应式为O2+2CO2+4e-2CO32-.
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)?CH3CH2OH(g).当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如图2:
(1)图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是:反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O):n(C2H4)=0.6:1.该条件下乙烯的转化率为5%.若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去、增加nH2O:nC2H4比.
Ⅳ.探究乙醇与溴水是否反应.
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如表:
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应.
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应.
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应(已知若发生氧化反应,则Br2全部转化为HBr):取含amolBr2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=amol则发生取代反应;若n(Br-)=2amol则发生氧化反应;若amol<n(Br-)<2amol则既发生了取代反应也发生了氧化反应.

10.已知溶液中有3种阴离子:Cl-,CO32-和SO42-.要求只取一次溶液,分别鉴别出3种阴离子的存在,有以下步骤:①滴加AgNO3溶液;
②滴加Ba(NO3)2溶液;
③滴加稀HNO3至过量;
④过滤
正确的操作顺序应当是( )
②滴加Ba(NO3)2溶液;
③滴加稀HNO3至过量;
④过滤
正确的操作顺序应当是( )
| A. | ①②③④ | B. | ②③④① | C. | ③②④① | D. | ①④②③ |
17.已知2SO2(g)+O2 (g)?2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A. | 容器内压强p p甲=p丙>2p乙 | |
| B. | SO3的质量m m甲=m丙<2m乙 | |
| C. | c(SO2)与c(O2)之比k k甲=k丙>2k乙 | |
| D. | 反应放出或吸收热量的数值Q Q甲=197-Q丙>2Q乙 |
14.下列离子方程式正确的是( )
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用NaOH溶液除去铝表面的氧化膜时产生气泡:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ | |
| C. | 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将铁粉加入稀硫酸和硝酸钾混合溶液中,铁粉溶解:Fe+2H+=Fe2++H2↑ |
11.下列离子方程式对应的化学方程式正确的是( )
| A. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | CO32-+2H+═CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O | |
| D. | Al(OH)3+OH-═AlO2-+2H2O Al(OH)3+NaOH═NaAlO2+2H2O |