题目内容
11.下列离子方程式对应的化学方程式正确的是( )| A. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | CO32-+2H+═CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O | |
| D. | Al(OH)3+OH-═AlO2-+2H2O Al(OH)3+NaOH═NaAlO2+2H2O |
分析 A.醋酸为弱酸不能完全电离;
B.水为弱电解质不能写成离子;
C.碳酸钙是难溶于水的固体,不能拆成离子;
D.氢氧化钠和偏铝酸钠都是易溶于水的强电解质.
解答 解:A.化学方程式中醋酸是弱酸不能完全电离,离子方程式中写分子式,CH3COOH+NaOH═CH3COONa+H2O的离子方程式为:CH3COOH+OH-═CH3COO-+H2O,故A错误;
B.Ba(OH)2+H2SO4═BaSO4↓+2H2O的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.CaCO3+2HCl═CaCl2+CO2↑+H2O反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.Al(OH)3+NaOH═NaAlO2+2H2O的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及离子反应方程式的意义,题目难度不大.

练习册系列答案
相关题目
1.作为新型燃料,氢气具有的突出优点是( )
| A. | 在自然界里存在氢气 | B. | 燃烧氢气污染小 | ||
| C. | 氢气轻,便于携带 | D. | 氢气燃烧发热量高 |
2.以下各溶液中Cl-物质的量浓度与300mL1mol•L-1NaCl溶液中Cl-物质的量浓度相同的是( )
| A. | 100mL 1mol/LAlCl3溶液 | B. | 200 mL 1mol/LMgCl2溶液 | ||
| C. | 100mL 0.5mol/LCaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 适当升高温度 | B. | 加入NH4Cl固体 | C. | 通入NH3 | D. | 加水稀释 |
6.下列物质中不能使溴水因发生化学反应而褪色,但能使酸性KMnO4溶液褪色的是( )
| A. | 乙烯 | B. | 苯 | C. | 乙苯 | D. | 乙烷 |
3.已知水的离子积在不同温度下分别为:KW(25℃)=1.0×10-14 mol2•L-2,KW(35℃)=2.1×10-14 mol2•L-2,则下列关于水的叙述正确的是( )
| A. | 水电离的[H+]随着温度的升高而降低 | B. | 在35℃时,水电离的[H+]>[OH-] | ||
| C. | 水的电离程度:35℃>25℃ | D. | 水电离的[OH-]随温度升高而增大 |
20.下列物质中,属于电解质的是( )
| A. | CH4 | B. | Al | C. | HCl | D. | 稀H2SO4 |
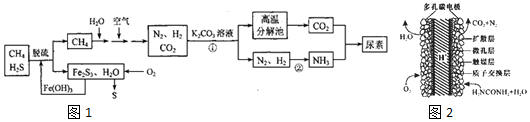
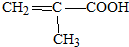 .
.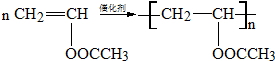 .
.
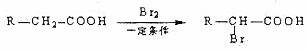 D可以发生如下转化关
D可以发生如下转化关 系:
系: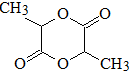 .并写出N发生消去反应的化学方程式CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
.并写出N发生消去反应的化学方程式CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.