题目内容
8.某次实验中,利用下图1所示的实验装置,用标准K0H溶液测定某盐酸的浓度.注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
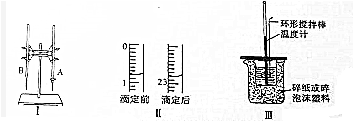
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
分析 (1)图Ⅰ所示用于酸碱中和滴定;图中A仪器是酸式滴定管;
(2)根据滴定管的结构以及测量体积的原理来分析;
(3)根据反应结束前溶液为无色,反应结束时溶液为浅红色判断滴定终点;
(4)等质量的NaOH和KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小;
(5)先判断数据的有效性,然后求出平均值,最后根据关系式K0H~HCl来计算出盐酸的浓度.
解答 解:(1)图Ⅰ所示实验名称是酸碱中和滴定;图中A仪器下端是玻璃塞,是酸式滴定管;
故答案为:酸碱中和滴定;酸式滴定管;
(2)滴定前读数为:0.80mL,滴定后读数为:22.80mL,消耗溶液的体积为22.00mL;
故答案为:22.00;
(3)①用标准K0H溶液测定某盐酸的浓度,反应结束前溶液为无色,滴定结束时溶液为浅红色,则滴定终点的现象为:溶液由无色变为浅红色,且半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)称取一定量的KOH固体(含少量NaOH),等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏低;
(5)三次滴定消耗标准液的体积分别为:22.02mL,24.00mL,21.98mL,第二次滴定数据误差过大,应该舍弃,其它两次消耗的标准液的平均体积为:
22.00mL
K0H~HCl
1 1
22.00mL×0.1000mol/L 20.0×C(HCl)
解得:C(HCl)=0.1100mol/L
故答案为:0.1100mol/L.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、仪器、误差以及注意事项,把握实验基本操作.

 智慧小复习系列答案
智慧小复习系列答案| A. | 25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- | |
| C. | NaHCO3溶液中:K+、Na+、SO42-、Al3+ | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、Cl-、NO3- |
| A. | 钠 | B. | 漂白粉 | C. | 氧化钠 | D. | 过氧化钠 |
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 氯水 |
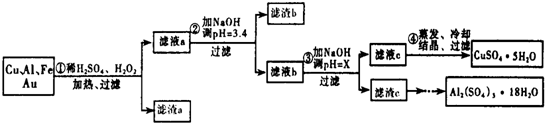
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mLNa2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
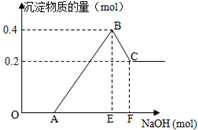 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图