题目内容
3.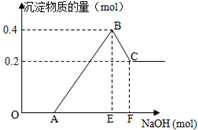 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图(1)写出各段离子方程式:
OA:H++OH-═H2O;
AB:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;
BC:Al(OH)3+OH-═AlO2-+2H2O.
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为1:1图中AE:EF=5:1.
分析 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,OA段发生反应为:H++OH-═H2O,AB段沉淀开始增大至最大的反应为:MgCl2+2NaOH═2NaCl+Mg(OH)2↓、AlCl3+3NaOH═3NaCl+Al(OH)3↓,BC段沉淀溶解,发生反应为:Al(OH)3+OH-═AlO2-+2H2O,根据图象可知氢氧化镁沉淀的物质的量为0.2mol,则氢氧化铝沉淀的物质的量为0.4mol-0.2mol=0.2mol,根据质量守恒定律可计算出镁离子、铝离子的浓度之比;根据镁离子、铝离子的物质的量可计算出AE:EF.
解答 解:在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,OA段发生反应为:H++OH-═H2O,AB段沉淀开始增大至最大的反应为:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,BC段沉淀溶解,发生反应为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:H++OH-═H2O;Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(2)根据图象可知,C点之后剩余的沉淀为氢氧化镁,氢氧化镁的物质的量为0.2mol,则氢氧化铝沉淀的物质的量为:0.4mol-0.2mol=0.2mol,
根据质量守恒定律可知:n(Mg2+)=[Mg(OH)2]=0.2mol、n(Al3+)=n[Al(OH)3]=0.2mol,由于在同一溶液中,则镁离子、铝离子的物质的量浓度之比等于其物质的量之比,所以原溶液中Mg2+、Al3+的物质的量浓度之比为:0.2mol:0.2mol=1:1;
AB段消耗氢氧化钠的物质的量为:0.2mol×2+0.2mol×3=1mol,BC段消耗氢氧化钠的物质的量为:0.2mol,所以AE:EF=1mol:0.2mol=5:1,
故答案为:1:1 5:1.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线变化对应反应原理及反应的先后顺序为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
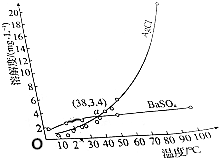
| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
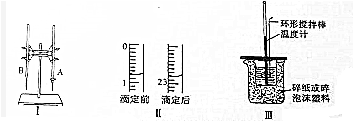
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
| A. | 甲苯无同分异构体 | |
| B. | 邻二甲苯只有一种 | |
| C. | 苯分子中各原子均在一个平面内,各键键角均为120° | |
| D. | 1mol苯最多只能与3mol H2加成 |
仅依据下表给出的物理量X和Y,其中不能求出物质的量的是
A | B | C | D | |
X | 物质中的粒子数 | 标准状况下的 气体摩尔体积 | 固体的体积 | 溶液中溶质的 物质的量浓度 |
Y | 阿伏加德罗常数 | 标准状况下 气体的体积 | 固体的密度 | 溶液体积 |
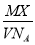 表示的是
表示的是 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q. 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 的
的