题目内容
19.下列几种物质露置于空气中都会变质,其中一种物质不同于另外三种物质的是( )| A. | 钠 | B. | 漂白粉 | C. | 氧化钠 | D. | 过氧化钠 |
分析 钠、漂白粉、过氧化钠露置于空气中分别发生下列反应:4Na+O2═2Na2O,Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,2HClO═2HCl+O2↑,2Na2O2+2H2O═4NaOH+O2↑,2Na2O2+2CO2═2Na2CO3+O2,均为氧化还原反应,而氧化钠露置于空气中,发生的反应为Na2O+CO2═Na2CO3,是非氧化还原反应,据此分析解答;
解答 解:钠、漂白粉、过氧化钠露置于空气中分别发生下列反应:4Na+O2═2Na2O,Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,2HClO═2HCl+O2↑,2Na2O2+2H2O═4NaOH+O2↑,2Na2O2+2CO2═2Na2CO3+O2,均为氧化还原反应,而氧化钠露置于空气中,发生的反应为Na2O+CO2═Na2CO3,是非氧化还原反应,所以四种物质露置于空气中发生反应,只有氧化钠发生非氧化还原反应,与其他三种不同,
故选:C.
点评 本题考查了物质发生的反应,明确钠及其化合物的性质是解题关键,注意从元素化合价是否变化判断氧化还原反应和非氧化还原反应,题目难度不大.

练习册系列答案
相关题目
12.下列关于酸碱中和滴定的说法错误的是( )
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
10.下列五种物质:①甲醇 ②甲醛 ③甲酸 ④甲酸甲酯 ⑤苯甲酸甲酯,其中能发生银镜反应的有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
4.NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 在标准状况下,2.24 L四氯甲烷中所含分子数为0.1NA | |
| D. | 1 mol苯分子中含有碳碳双键数为3 NA |
8.某次实验中,利用下图1所示的实验装置,用标准K0H溶液测定某盐酸的浓度.
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
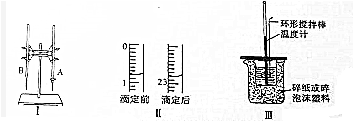
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.

(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
9. 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:X>Y>Z>W | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |

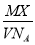 表示的是
表示的是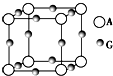 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.