题目内容
17.下列状态时,不能导电的是( )| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 氯水 |
分析 含有自由移动离子或电子的物质能导电,根据选项的物质中是否含有自由移动离子或电子分析解答.
解答 解:A.液态氯化氢中只含氯化氢分子,不含自由移动电子或离子,所以不能导电,故A选;
B.熔融态的食盐中含有自由移动离子,所以能导电,故B不选;
C.硫酸铜溶液中含有只有移动离子,所以能导电,故C不选;
D.氯水中含有自由移动离子,所以能导电,故D不选;
故选A.
点评 本题考查物质导电性判断,为高频考点,明确物质导电原理是解本题关键,易错选项是D,氯气和水生成的HCl、HClO在水溶液中电离出阴阳离子而导致氯水导电,但液氯不导电.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列五种物质:①甲醇 ②甲醛 ③甲酸 ④甲酸甲酯 ⑤苯甲酸甲酯,其中能发生银镜反应的有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
8.某次实验中,利用下图1所示的实验装置,用标准K0H溶液测定某盐酸的浓度.
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
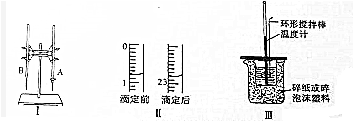
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.

(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
5.MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):

已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.

已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
2.下列叙述,错误的是( )
| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
9. 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:X>Y>Z>W | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
6.与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是( )
| A. | HC≡CCH(CH3)C(CH3)3 | B. | CH2═CHC(CH3)2CH(CH3)2 | ||
| C. | (CH3)3CC(CH3)═CHCH3 | D. | (CH3)3CCH(CH3)CH═CH2 |
4.下列各组物质性质比较的表示中,正确的是( )
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.