题目内容
17.信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:部分阳离子以氢氧化物形式沉淀时溶液的pH见表: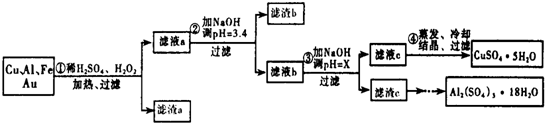
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mLNa2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
分析 金属混合物加入稀硫酸,铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有Fe3+、Al3+和Cu2+等阳离子,加入氢氧化钠溶液调节溶液PH=3.4,使Fe3+转化为沉淀Fe(OH)3沉淀,过滤分离,滤液含有Al3+和Cu2+等阳离子,再加入氢氧化钠溶液调节溶液PH=5.2-5.4之间,使Al3+全部沉淀过滤得到滤渣c为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体;得到滤液c为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体.
(1)过滤操作用到的仪器有烧杯、漏斗、玻璃棒;
(2)Cu溶于稀硫酸与H2O2的混合溶液,反应生成硫酸铜与水;
(3)Cu、Al及少量Fe、Au等金属的混合物,其中铜、铝、铁都发生反应而溶解,Au化学性质稳定,成为滤渣a的主要成分;
(4)滤渣c是氢氧化铝,根据部分阳离子以氢氧化物形式沉淀时溶液的pH表,选择使氢氧化铝沉淀完全且氢氧化铜不沉淀的pH;
(5)①依据滴定实验发生的反应的定量关系进行计算样品中所含铜离子物质的量,结合元素守恒计算硫酸铜晶体质量分数;
②样品中含有硫酸钠,测定硫酸根离子含量不能计算得到硫酸铜晶体的含量;
(6)滤渣C主要是氢氧铝,加入硫酸溶解后通过这蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)3•18H2O.
解答 解:金属混合物加入稀硫酸,铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有Fe3+、Al3+和Cu2+等阳离子,加入氢氧化钠溶液调节溶液PH=3.4,使Fe3+转化为沉淀Fe(OH)3沉淀,过滤分离,滤液含有Al3+和Cu2+等阳离子,再加入氢氧化钠溶液调节溶液PH=5.2-5.4之间,使Al3+全部沉淀过滤得到滤渣c为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体;得到滤液c为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体.
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗,
故答案为:烧杯、漏斗、玻璃棒;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是:Cu+H2O2+2H+═Cu2++2H2O,
故答案为:Cu+H2O2+2H+═Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中,故答案为:Au;
(4)加入氢氧化钠溶液调节PH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀pH=4,沉淀完全pH=5.2,氢氧化铜开始沉淀pH=5.4,所以选择的pH范围是:5.2≤X<5.4,
故答案为:5.2≤X<5.4;
(5)①由2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-可知反应的定量关系为:2Cu2+~I2 ~2S2O32-,则n(Cu2+)=n(S2O32-)=0.100 0mol•L-1×0.014.00L=1.4×10-3mol,
故100mL溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数=$\frac{1.4×1{0}^{-2}mol×250g/mol}{4.0g}$×100%=87.5%,
故答案为:87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数,
故答案为:样品中含有Na2SO4等杂质;
(6)分析流程可知,滤渣C主要是氢氧铝,加入硫酸溶解后通过这蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)3•18H2O,
故答案为:将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
点评 本题考查物质准备工艺流程,涉及物质的分离和提纯、制备方案的设计、物质含量测定、实验基本操作等,题目难度中等,试题培养了学生的分析能力及化学实验能力.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
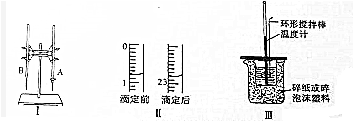
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:X>Y>Z>W | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
| A. | HC≡CCH(CH3)C(CH3)3 | B. | CH2═CHC(CH3)2CH(CH3)2 | ||
| C. | (CH3)3CC(CH3)═CHCH3 | D. | (CH3)3CCH(CH3)CH═CH2 |
仅依据下表给出的物理量X和Y,其中不能求出物质的量的是
A | B | C | D | |
X | 物质中的粒子数 | 标准状况下的 气体摩尔体积 | 固体的体积 | 溶液中溶质的 物质的量浓度 |
Y | 阿伏加德罗常数 | 标准状况下 气体的体积 | 固体的密度 | 溶液体积 |
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
| A. | 镁 | B. | 铁 | C. | 铜 | D. | 银 |
 的
的