题目内容
20.有一含杂质的亚硫酸钠试剂,为测定它的纯度,进行以下实验:称取7.0g样品,溶于足量的稀硫酸中并微热.将产生的气体通入足量的浓溴水中,并加入足量的氯化钡溶液,反应完全后得沉淀11.65g,则此亚硫酸钠试剂的纯度是多少?分析 由信息可知,亚硫酸钠与硫酸反应生成二氧化硫,二氧化硫与溴水反应生成硫酸,再与氯化钡结合生成硫酸钡沉淀,结合S原子守恒计算.
解答 解:由信息可知,亚硫酸钠与硫酸反应生成二氧化硫,二氧化硫与溴水反应生成硫酸,再与氯化钡结合生成硫酸钡沉淀,
由S原子守恒可知,Na2SO3~SO2~BaSO4,
n(BaSO4)=$\frac{11.65g}{233g/mol}$=0.05mol,
则此亚硫酸钠试剂的纯度是$\frac{0.05mol×126g/mol}{7.0g}$×100%=90%,
答:此亚硫酸钠试剂的纯度是90%.
点评 本题考查化学反应的计算,为高频考点,侧重于分析与计算能力的考查,注意把握S原子守恒及沉淀为硫酸钡,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
8.某次实验中,利用下图1所示的实验装置,用标准K0H溶液测定某盐酸的浓度.
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.
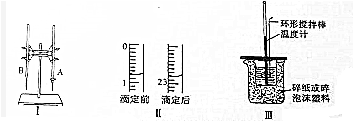
(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
注:①K0H标准液浓度为0.1000mol/L.②实验中使用酚酞作指示剂.
请回答下列问题.

(1)图Ⅰ所示实验名称是酸碱中和滴定图中A仪器的名称是酸式滴定管
(2)图Ⅱ是这次实验前后某同学使用的盛装K0H溶液的滴定管的体积读数.则消耗的K0H溶液的体积为22.00mL;
(3)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;
(4)若称取的K0H固体中含少量Na0H,用这种K0H固体配制标准溶液滴定上述盐酸,对测得盐酸浓度的影响偏低(填“偏高”“偏低”或“无影响”).
(5)重复该实验3次,所得实验数据如下表:待测得盐酸的物质的量的浓度为0.1100mol/L(保留四位有效数字)
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
15.能够说明苯分子中不存在单、双键,而是所有碳碳键完全相同的事实是( )
| A. | 甲苯无同分异构体 | |
| B. | 邻二甲苯只有一种 | |
| C. | 苯分子中各原子均在一个平面内,各键键角均为120° | |
| D. | 1mol苯最多只能与3mol H2加成 |
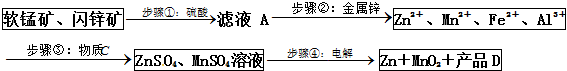
5.MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.

已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
9. 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:X>Y>Z>W | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |

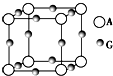 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q. 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.