题目内容
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 ,形成的简单离子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物,写出该化合物的电子式: .
(4)②的气态氢化物与④的单质反应可形成常见的燃料电池,写出该电池在KOH溶液中负极的电极反应式 .
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 ,M中阳离子的电子式 .
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物,写出该化合物的电子式:
(4)②的气态氢化物与④的单质反应可形成常见的燃料电池,写出该电池在KOH溶液中负极的电极反应式
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
考点:无机物的推断,元素周期律和元素周期表的综合应用
专题:推断题,元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多原子半径越大,同一周期中,原子半径随着原子序数增大而减小;电子层结构相同的离子,其离子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物为NaOH,钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
(4)②的气态氢化物为甲烷、④的单质为氧气,二者反应可形成常见的燃料电池,负极上燃料失电子和氢离子反应生成二氧化碳和水;
(5)⑥的单质是Al,电解氧化铝得到Al,则N是Al2O3,加热Al(OH)3得到Al2O3,
则Z是Al(OH)3,M是仅含非金属元素的盐,且这几种元素都是表中元素,则M是NH4Cl,X和Y在水溶液里反应生成氢氧化铝和氯化铵,根据复分解反应特点知,X和Y中一种是氨水、一种是氯化铝,据此分析解答.
(1)原子电子层数越多原子半径越大,同一周期中,原子半径随着原子序数增大而减小;电子层结构相同的离子,其离子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物为NaOH,钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
(4)②的气态氢化物为甲烷、④的单质为氧气,二者反应可形成常见的燃料电池,负极上燃料失电子和氢离子反应生成二氧化碳和水;
(5)⑥的单质是Al,电解氧化铝得到Al,则N是Al2O3,加热Al(OH)3得到Al2O3,
则Z是Al(OH)3,M是仅含非金属元素的盐,且这几种元素都是表中元素,则M是NH4Cl,X和Y在水溶液里反应生成氢氧化铝和氯化铵,根据复分解反应特点知,X和Y中一种是氨水、一种是氯化铝,据此分析解答.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)电子层数④<⑤、⑥,⑤、⑥电子层数相等但原子序数⑤<⑥,所以原子半径⑤>⑥>④;电子层结构相同的离子,其离子半径随着原子序数增大而减小,所以离子半径大小顺序是④>⑤>⑥,
故答案为:⑤>⑥>④;④>⑤>⑥;
(2)非金属性③>②>⑦,则元素最高价氧化物的水化物的酸性③>②>⑦,故答案为:③>②>⑦;
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物为NaOH,钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,其电子式为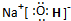 ,故答案为:
,故答案为: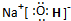 ;
;
(4)②的气态氢化物为甲烷、④的单质为氧气,二者反应可形成常见的燃料电池,负极上燃料失电子和氢离子反应生成二氧化碳和水,所以负极反应为CH4-8e-+2H2O=CO2+8H+,故答案为:CH4-8e-+2H2O=CO2+8H+;
(5)⑥的单质是Al,电解氧化铝得到Al,则N是Al2O3,加热Al(OH)3得到Al2O3,
则Z是Al(OH)3,M是仅含非金属元素的盐,且这几种元素都是表中元素,则M是NH4Cl,X和Y在水溶液里反应生成氢氧化铝和氯化铵,根据复分解反应特点知,X和Y中一种是氨水、一种是氯化铝,
X和Y反应离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,M中阳离子是铵根离子,其电子式为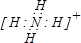 ,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;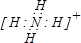 .
.
(1)电子层数④<⑤、⑥,⑤、⑥电子层数相等但原子序数⑤<⑥,所以原子半径⑤>⑥>④;电子层结构相同的离子,其离子半径随着原子序数增大而减小,所以离子半径大小顺序是④>⑤>⑥,
故答案为:⑤>⑥>④;④>⑤>⑥;
(2)非金属性③>②>⑦,则元素最高价氧化物的水化物的酸性③>②>⑦,故答案为:③>②>⑦;
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物为NaOH,钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,其电子式为
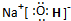 ,故答案为:
,故答案为: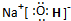 ;
;(4)②的气态氢化物为甲烷、④的单质为氧气,二者反应可形成常见的燃料电池,负极上燃料失电子和氢离子反应生成二氧化碳和水,所以负极反应为CH4-8e-+2H2O=CO2+8H+,故答案为:CH4-8e-+2H2O=CO2+8H+;
(5)⑥的单质是Al,电解氧化铝得到Al,则N是Al2O3,加热Al(OH)3得到Al2O3,
则Z是Al(OH)3,M是仅含非金属元素的盐,且这几种元素都是表中元素,则M是NH4Cl,X和Y在水溶液里反应生成氢氧化铝和氯化铵,根据复分解反应特点知,X和Y中一种是氨水、一种是氯化铝,
X和Y反应离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,M中阳离子是铵根离子,其电子式为
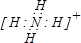 ,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;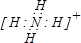 .
.
点评:本题考查较综合,涉及无机物推断及元素周期律等知识点,根据元素周期律及物质结构、性质分析解答,难点是燃料电池电极反应式的书写.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、反应物的总能量一定高于生成物的总能量 |
| B、铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C、化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
短周期元素A、B、C、D的原子序数依次增大.A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族.下列说法正确的是( )
| A、原子半径:D>B>C>A |
| B、元素A、B的氧化物具有相同类型的化学键 |
| C、元素B和C的最高价氧化物对应水化物的碱性:B>C |
| D、B、C、D的最高价氧化物对应的水化物能相互反应 |
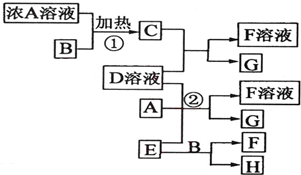
 完成下列问题.
完成下列问题. 如图中A~J分别代表相关反应的一种物质.已知A为NH4HCO3,分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白:
如图中A~J分别代表相关反应的一种物质.已知A为NH4HCO3,分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白: