题目内容
 完成下列问题.
完成下列问题.(1)Si、P、S三种元素的电负性由大到小的顺序是
(2)下列说法正确的是
A.CO2和H2S分子都是直线形
B.P4、BF3和HCN都是非极性分子
C.C2H2分子中含有σ键与π键的个数比为3:2
D.α-氨基-丙酸分子中碳原子的杂化方式有:sp2、sp3
(3)乙酸分子间存在以氢键缔合的二聚体(含一个环状结构),请画出这种二聚体的结构:
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.在V2O5、CrO2和Fe2O3三种离子型氧化物中,磁记录性能最好的是
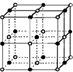
(5)实验证明:KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似(如图所示),已知部分离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有
考点:元素电离能、电负性的含义及应用,判断简单分子或离子的构型,晶胞的计算,极性分子和非极性分子,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)同一周期元素中,从左到右元素电负性增强;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常;
(2)A.根据中心原子的价层电子对数判断;
B.根据分子的正负电荷中心是否重叠分析;
C.根据C2H2结构式分析;
D.根据α-氨基-丙酸分子( )中碳原子的共价键分析;
)中碳原子的共价键分析;
(3)在二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键;
(4)根据钒离子、铬离子和铁离子的未成对电子判断;
(5)晶格能越大熔点越高;根据MgO晶胞的结构,可以确定一个Mg2+周围和它最邻近且等距离的Mg2+有数目.
(2)A.根据中心原子的价层电子对数判断;
B.根据分子的正负电荷中心是否重叠分析;
C.根据C2H2结构式分析;
D.根据α-氨基-丙酸分子(
 )中碳原子的共价键分析;
)中碳原子的共价键分析;(3)在二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键;
(4)根据钒离子、铬离子和铁离子的未成对电子判断;
(5)晶格能越大熔点越高;根据MgO晶胞的结构,可以确定一个Mg2+周围和它最邻近且等距离的Mg2+有数目.
解答:
解:(1)同一周期元素中,元素的电负性随着原子序数的增大而增大,所以Si、P、S三种元素的电负性由大到小的顺序是S>P>Si;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常,Si、P、S三种元素原子的第一电离能由大到小的顺序是P>S>Si;
故答案为:S>P>Si;P>S>Si;
(2)A.CO2中心原子的价层电子对数为2,为直线形分子,H2S中心原子的价层电子对数为4,且含有2个孤电子对,属于V形,故A错误;
B.P4、BF3分子的正负电荷中心重叠为非极性分子,HCN是极性分子,故B错误;
C.C2H2结构式为H-C≡C-H,分子中含有2个单键和1个三键,则σ键与π键的个数比为3:2,故C正确;
D.α-氨基-丙酸分子( )中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;
)中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;
故答案为:CD;
(3)二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键,所以其氢键表示为 ,
,
故答案为: ;
;
(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6,无未成对电子,CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2两对未成对电子,而Fe2O3中Fe3+电子排布式为1s22s22p63s23p63d5有5对未成对电子,以Fe2O3中的未成对电子数最多,故答案为:Fe2O3;
(5)KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,TiN中离子都带3个单位电荷,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-<N3-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能TiN>MgO>CaO>KCl,故熔点TiN>MgO>CaO>KCl;
在MgO晶胞中Mg2+周围有六个O2-,O2-周围有六个Mg2+,根据晶胞的结构可以看出,如果以体心上一个Mg2+为究对象,和它最邻近且等距离的Mg2+分布在晶胞每个棱边中点上,共有12个,
故答案为:TiN>MgO>CaO>KCl;12.
故答案为:S>P>Si;P>S>Si;
(2)A.CO2中心原子的价层电子对数为2,为直线形分子,H2S中心原子的价层电子对数为4,且含有2个孤电子对,属于V形,故A错误;
B.P4、BF3分子的正负电荷中心重叠为非极性分子,HCN是极性分子,故B错误;
C.C2H2结构式为H-C≡C-H,分子中含有2个单键和1个三键,则σ键与π键的个数比为3:2,故C正确;
D.α-氨基-丙酸分子(
 )中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;
)中甲基上碳原子形成4个共价键为sp3杂化,羧基上碳原子含有1个C=O和1个C-H、1个C-O,共3个价层电子对,为sp2杂化,故D正确;故答案为:CD;
(3)二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键,所以其氢键表示为
 ,
,故答案为:
 ;
;(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6,无未成对电子,CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2两对未成对电子,而Fe2O3中Fe3+电子排布式为1s22s22p63s23p63d5有5对未成对电子,以Fe2O3中的未成对电子数最多,故答案为:Fe2O3;
(5)KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,TiN中离子都带3个单位电荷,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-<N3-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能TiN>MgO>CaO>KCl,故熔点TiN>MgO>CaO>KCl;
在MgO晶胞中Mg2+周围有六个O2-,O2-周围有六个Mg2+,根据晶胞的结构可以看出,如果以体心上一个Mg2+为究对象,和它最邻近且等距离的Mg2+分布在晶胞每个棱边中点上,共有12个,
故答案为:TiN>MgO>CaO>KCl;12.
点评:本题考查较综合,涉及电负性的比较、第一电离能的比较、杂化类型的判断、分子的极性、核外电子排布式、离子晶体熔点的比较等知识点,难点是氢键的书写,明确哪些元素的原子能形成氢键,题目难度中等.

练习册系列答案
相关题目
常温下,下列溶液中酸性最弱的是( )
| A、pH=4 |
| B、[H+]=1×10-3mol?L-1 |
| C、[OH-]=1×10-12mol?L-1 |
| D、[OH-]=1×10-14mol?L-1 |
下列图示与对应的叙述相符的是( )


| A、图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉 |
| B、图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2 |
| C、图3表示表示向盐酸和醋酸混合溶液中滴入氨水 |
| D、图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |

 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答: