题目内容
2.某同学进行下列实验:下列说法合理的是( )| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
分析 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住,烧杯A中铜与浓硝酸反应生成二氧化氮气体,反应方程式为:Cu+4HNO3═Cu(NO3)2+NO2↑+2H2O;A中生成的二氧化氮气体与C中水反应生成硝酸,且浓硝酸具有挥发性,导致C中碘离子被硝酸氧化成碘单质,C中溶液变蓝,据此进行解答.
解答 解:A.铜与浓硝酸反应生成的是二氧化氮气体,正确的反应为:Cu+4HNO3═Cu(NO3)2+NO2↑+2H2O,故A错误;
B.二氧化氮能够直接与水反应生成硝酸和无色的NO,所以红棕色气体消失与NO2和烧杯C中的KI发生反应有关,也与二氧化氮与水反应有关,故B错误;
C.浓硝酸具有挥发性,则烧杯C中溶液变蓝与NO2和C中溶液发生反应有关,也与挥发出的硝酸有关,故C错误;
D.若将铜片换成铁片,铁与浓硝酸发生钝化,由于浓硝酸具有挥发性,则焕发出的硝酸能够氧化碘离子,导致C中的液体也可能变蓝,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,明确实验原理为解答关键,C为易错点,注意浓硝酸具有挥发性的影响,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
13.将4mol A和2mol B在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(s)+B(g)?2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
10.下列关于胶体的叙述中,不正确的是( )
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
17.某温度下,水的离子积常数KW=1×10-12.该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A. | 1:10 | B. | 9:1 | C. | 1:9 | D. | 99:21 |
7.下列说法中,正确的是( )
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
14.与氢氧根具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4+ | C. | Cl- | D. | NH2- |
11.天平的左、右托盘上分别放有一个盛有100mL 1mol/L盐酸的等质量的烧杯,此时天平保持平衡,然后在左盘烧杯内投入10g钠,右盘烧杯内投入10g锌,充分反应后,最终天平的状态是( )
| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
14.下列说法不正确的是( )
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
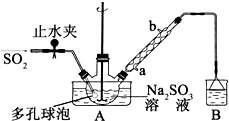 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: