题目内容
12.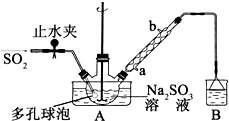 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B的烧杯中应加入的溶液是氢氧化钠溶液;
(2)A中多孔球泡的作用是增大气体与溶液的接触面积,加快气体的吸收速率.
(3)冷凝管中回流的主要物质除H2O外还有HCHO(填化学式).
(4)写出步骤2中发生反应的化学方程式NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2.
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化.
(6)①抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称)
②如果抽滤的溶液具有强氧化性时,可采取用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗的措施
(7)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为77%.
分析 (1)未反应的二氧化硫气体是酸性氧化物能和碱溶液反应;根据采用逆流冷却效果好判断进水口;
(2)多孔球泡可以增大气体与液体的接触面积;
(3)甲醛易挥发,据此判断回流物质;
(4)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀;
(5)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;
(6)①抽滤装置的组成和原理分析判断仪器;
②当过滤的溶液具有强酸性、强碱性或强氧化性时,会腐蚀滤纸;
(7)根据反应NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO和NaHSO4+BaCl2=BaSO4↓+HCl+NaCl得关系式NaHSO2•HCHO•2H2O~BaCl2,可计算得纯NaHSO2•HCHO•2H2O的质量,根据纯度=次硫酸氢钠甲醛的质量除以样品的质量得到纯度.
解答 解:(1)实验中未参与反应的二氧化硫气体会通过导气管进入B装置,可以用氢氧化钠溶液吸收二氧化硫乙防止污染空气,故答案为:氢氧化钠溶液;
(2)多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率,
故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)HCHO易挥发,在80°C-90°C条件下会大量挥发,所以冷凝管中回流的主要物质除H2O 外还有HCHO,
故答案为:HCHO;
(4)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,反应方程式为NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2,
故答案为:NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2;
(5)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化,所以步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化,
故答案为:防止温度过高使产物分解,也防止氧气将产物氧化;
(6)①抽滤装置不同于普通过滤装置,由减压系统(真空泵),吸滤瓶和布氏漏斗等组成,故答案为:吸滤瓶;布氏漏斗;
②当过滤的溶液具有强酸性、强碱性或强氧化性时,会腐蚀滤纸,此时可用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗的措施,
故答案为:用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗;
(7)根据反应NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO和NaHSO4+BaCl2=BaSO4↓+HCl+NaCl得关系式NaHSO2•HCHO•2H2O~BaCl2,硫酸钡的质量为0.466g,其物质的量为0.002mol,所以样品中纯NaHSO2•HCHO•2H2O的质量为0.002mol×$\frac{100}{20}$×154g/mol=1.54g,所以纯度=$\frac{1.54g}{2g}$×100%=77%,
故答案为:77%.
点评 本题考查了实验制备方案的设计,实验步骤的操作,仪器使用方法,反应过程中的物质判断,题目难度中等.

| A. | 60% | B. | 40% | C. | 30% | D. | 70% |
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |

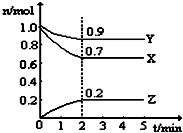 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: