题目内容
20.下列说法正确的是( )| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c(H+)+c(HA) |
分析 A.n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1mol/L=0.15mol,n(CO2):n(NaOH)=0.1mol:0.15mol=1:1.5,1:2<n(CO2):n(NaOH)<1:1,故发生反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,反应后为Na2CO3、NaHCO3混合溶液,根据钠离子守恒、碳元素守恒计算溶液中Na2CO3、NaHCO3的物质的量,HCO3-水解程度大于其电离程度,CO32-的水解程度大于HCO3-的水解程度,据此判断碳酸根离子和碳酸氢根离子浓度大小;
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
C.NaHB溶液的pH=9,说明HB-的电离程度小于HB-的水解程度,则c(B2-)<c(H2B);
D.反应后溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),再结合电荷守恒进行判断.
解答 解:A.二氧化碳的物质的量为:n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1mol/L=0.15mol,n(CO2):n(NaOH)=0.1mol:0.15mol=1:1.5,1:2<n(CO2):n(NaOH)<1:1,故发生反应CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,反应后为Na2CO3、NaHCO3混合溶液,设Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则:x+y=0.1mol、2x+y=0.15,解得:x=0.05、y=0.05,HCO3-水解程度大于其电离程度,CO32-的水解程度大于HCO3-的水解程度,故c(HCO3-)>c(CO32-),故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故B错误;
C.0.1 mol•L-1 pH为9的NaHB溶液为碱性,说明HB-的电离程度小于HB-的水解程度,则c(B2-)<c(H2B),溶液中离子浓度大小为:c(HB-)>c(H2B)>c(B2-),故C错误;
D.室温下将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化),溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),结合电荷守恒c(A-)+c (OH-)=c(H+)+c(Na+)可得:c(A-)+c (OH-)>c(H+)+c(HA),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒等知识在判断离子浓度大小中的应用方法,试题培养了学生得到分析能力及灵活应用能力.

| A. | 分子式为C3H6有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双健 | |
| C. | 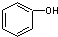 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以确定有机物结构简式为C2H5-OH |
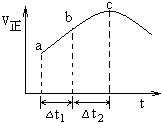 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 该反应为放热反应 | |
| B. | 反应物浓度:c>b>a | |
| C. | a、b均未建立平衡,c点恰好达到平衡 | |
| D. | 若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率 |
| A. | 氯化钠的电子式 | B. | 氢气的结构式H=H | ||
| C. | 磷原子的结构示意图 | D. | 乙酸的分子式C2H4O2 |
| A. | 乙烯的结构简式:CH2CH2 | B. | NaCl的电子式: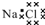 | ||
| C. | Cl-的结构示意图: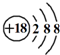 | D. | CH4的比例模型: |
| A. |  | B. |  | C. |  | D. |  |
| A. | 增加酯的用量 | B. | 增加水的用量 | ||
| C. | 加热 | D. | 加入氢氧化钡溶液并加热 |
| A. | 用食醋鉴别食盐和纯碱 | |
| B. | 用丁达尔效应现象鉴别蛋白质溶液和蔗糖溶液 | |
| C. | 用Ca(OH)2溶液鉴别SO2、CO2气体 | |
| D. | 用硝酸银溶液鉴别溴蒸气和二氧化氮气体 |
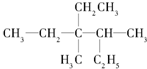 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷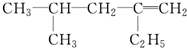
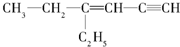 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8