题目内容
11.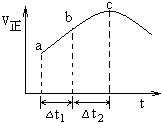 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 该反应为放热反应 | |
| B. | 反应物浓度:c>b>a | |
| C. | a、b均未建立平衡,c点恰好达到平衡 | |
| D. | 若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率 |
分析 由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快,平衡逆向进行.
解答 解:A、从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故A正确;
B、a到b时正反应速率增加,反应物浓度随时间不断减小,c<b<a,故B错误;
C、化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故C错误;
D、若在恒温恒容容器中,以相同的投料进行该反应,随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,反应物的转化率将逐渐增大,分析可知反应是放热反应,绝热恒容容器中随温度升高,平衡逆向进行,反应物的转化率减小,所以若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率大于绝热恒容容器中的转化率,故D错误;
故选A.
点评 本题考查化学反应速率和平衡图象,注意该反应的特点及反应限制条件,一定要读懂,“绝热恒容密闭容器”这句话表达的含义,难度较大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
8.下列实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  观察K+的焰色 |
9.下列电离方程式中,正确的是( )
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
6.下列关于金属元素特征的叙述中,正确的是( )
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中都显正价
③元素的金属性越强,相应的离子氧化性越弱
④失电子数越多,元素的金属性越强.
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中都显正价
③元素的金属性越强,相应的离子氧化性越弱
④失电子数越多,元素的金属性越强.
| A. | .①②③ | B. | ②③ | C. | ① | D. | 全部 |
16.如图是验证某气体化学性质的实验装置,如打开B,从A处通干燥的氯气,C中干燥的红色布条无变化,如关闭B,C中干燥的红色布条褪色,则D中 所装溶液是( )
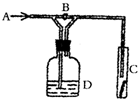

| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | NaBr溶液 |
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
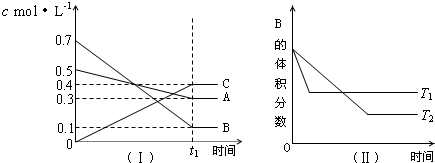

| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |
20.下列说法正确的是( )
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c(H+)+c(HA) |
1.下列关于${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$的说法正确的是( )
| A. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$不是同一种元素 | |
| B. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$互为同位素 | |
| C. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$都含有34个中子 |
 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题: