题目内容
8.下列化学用语正确的是( )| A. | 氯化钠的电子式 | B. | 氢气的结构式H=H | ||
| C. | 磷原子的结构示意图 | D. | 乙酸的分子式C2H4O2 |
分析 A.钠离子、氯离子的表示方法错误;
B.氢气分子中含有1个H-H键,不存在双键.
C.P的质子数为15,其原子核外电子数为15;
D.1个乙酸分子中含2个C、4个H、2个O原子.
解答 解:A.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出所带电荷甲基最外层电子,氯化钠正确的电子式为 ,故A错误;
,故A错误;
B.氢气分子中不存在双键,氢气正确的结构式为H-H,故B错误;
C.磷原子的核电荷数=核外电子总数=15,最外层含有5个电子,其正确的结构示意图为: ,故C错误;
,故C错误;
D.1个乙酸分子中含2个C、4个H、2个O原子,其分子式为:C2H4O2,故D正确;
故选D.
点评 本题考查化学用语的表示方法,为高频考点,题目难度中等,涉及结构示意图、电子式、结构式、分子式等知识,明确化学用语的区别及规范应用为解答的关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
5.在298K、1.01×105Pa下,将22g CO2通入750mL 1mol•L-1 NaOH的溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2mol•L-1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
16.如图是验证某气体化学性质的实验装置,如打开B,从A处通干燥的氯气,C中干燥的红色布条无变化,如关闭B,C中干燥的红色布条褪色,则D中 所装溶液是( )
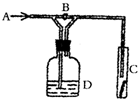

| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | NaBr溶液 |
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
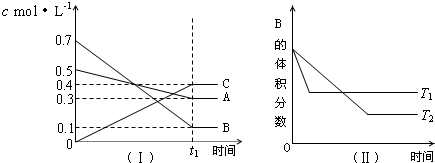

| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |
13.不同元素的原子,一定具有不同的( )
| A. | 质量数 | B. | 质子数 | C. | 中子数 | D. | 电子数 |
20.下列说法正确的是( )
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c(H+)+c(HA) |
17.下列反应过程符合如图所示关系的是( )
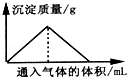

| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向NaAlO2溶液中通入HCl气体至过量 |
18.某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)( )
| A. | C2H4 | B. | CH3CHO | C. | CH3COOH | D. | CH2OHCH2OH |
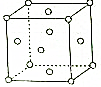 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题: