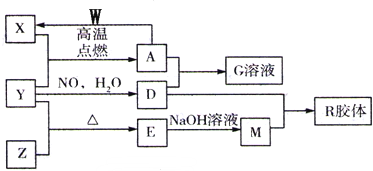
题目内容
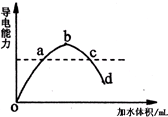 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答:(1)a、b、c、d四点溶液c(H+)的大小顺序是
(2)a、b、c、d四点醋酸的电离程度最大的是
(3)若向c点溶液中加少量的冰醋酸,则醋酸的导电能力
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)溶液导电能力越大,溶液中c(H+)浓度越大;
(2)醋酸是弱酸,醋酸电离程度与其浓度成反比;
(3)若向c点溶液中加少量的冰醋酸,醋酸浓度增大,平衡向电离方向移动,溶液中离子浓度增大.
(2)醋酸是弱酸,醋酸电离程度与其浓度成反比;
(3)若向c点溶液中加少量的冰醋酸,醋酸浓度增大,平衡向电离方向移动,溶液中离子浓度增大.
解答:
解:(1)溶液导电能力与离子浓度成正比,所以导电能力越大,溶液中c(H+)浓度越大,根据图象知,a、b、c、d四点溶液c(H+)的大小顺序是b>a=c>d,故答案为:b>a=c>d;
(2)醋酸是弱酸,醋酸电离程度与其浓度成反比,所以溶液越稀其电离程度越大,根据图象知,溶液浓度最小的是d,所以a、b、c、d四点醋酸的电离程度最大d,故答案为:d;
(3)若向c点溶液中加少量的冰醋酸,醋酸浓度增大,平衡向电离方向移动,溶液中离子浓度增大,则溶液导电能力增大,故答案为:增大.
(2)醋酸是弱酸,醋酸电离程度与其浓度成反比,所以溶液越稀其电离程度越大,根据图象知,溶液浓度最小的是d,所以a、b、c、d四点醋酸的电离程度最大d,故答案为:d;
(3)若向c点溶液中加少量的冰醋酸,醋酸浓度增大,平衡向电离方向移动,溶液中离子浓度增大,则溶液导电能力增大,故答案为:增大.
点评:本题考查弱电解质电离,明确弱电解质电离程度与浓度关系、溶液导电能力大小影响因素等知识点即可解答,注意:溶液导电能力与离子浓度、离子所带电荷有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
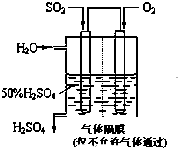
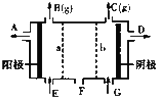 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知: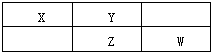 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示: