题目内容
现有①0.2mol/L NaOH溶液②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-).则:
(1)①中由水电离出的c(OH-) ②中由水电离出的c(H+)(填“>”、“<”或“=”).
(2)上述混合液中共存在 种粒子,且c(HX) c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-) 0.1mol/L(忽略体积变化)
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 .
(1)①中由水电离出的c(OH-)
(2)上述混合液中共存在
(3)上述混合液显
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)①根据碱和酸的电离对水的电离影响判断;
(2)根据NaA中的水解平衡和电离情况、盐的水解实质以及物料守恒来回答;
(3)强碱弱酸盐中弱离子水解会导致溶液显示碱性.
(2)根据NaA中的水解平衡和电离情况、盐的水解实质以及物料守恒来回答;
(3)强碱弱酸盐中弱离子水解会导致溶液显示碱性.
解答:
解:0.2mol/L NaOH溶液②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-),则HX酸是弱酸;
(1)碱、酸的电离抑制水的电离,0.2mol/L NaOH溶液中水电离出的氢离子浓度是5×10-14mol/L,0.2mol/L HX中氢离子浓度大于5×10-14mol/L,
所以混合溶液中由水电离出的c(OH-)<0.1mol/L 的HX溶液中由水电离出的c(H+),故答案为:<;
(2)①0.2mol/L NaOH溶液②0.2mol/L HX溶液,两溶液等体积混合后,所得溶液示NaX溶液,A-离子会水解得到HA,所以溶液和总存在Na+、A-、HX、H+、OH-、
H2O共6种微粒,NaX溶液中,c(HX)<c(X-),存在物料守恒:c(HX)+c(X-)=c(Na+)=0.1mol/L,故答案为:6;<;=;
(3)HX酸是弱酸,NaX溶液显示碱性,因为:X-+H2O?HX+OH-,故答案为:X-+H2O?HX+OH-.
(1)碱、酸的电离抑制水的电离,0.2mol/L NaOH溶液中水电离出的氢离子浓度是5×10-14mol/L,0.2mol/L HX中氢离子浓度大于5×10-14mol/L,
所以混合溶液中由水电离出的c(OH-)<0.1mol/L 的HX溶液中由水电离出的c(H+),故答案为:<;
(2)①0.2mol/L NaOH溶液②0.2mol/L HX溶液,两溶液等体积混合后,所得溶液示NaX溶液,A-离子会水解得到HA,所以溶液和总存在Na+、A-、HX、H+、OH-、
H2O共6种微粒,NaX溶液中,c(HX)<c(X-),存在物料守恒:c(HX)+c(X-)=c(Na+)=0.1mol/L,故答案为:6;<;=;
(3)HX酸是弱酸,NaX溶液显示碱性,因为:X-+H2O?HX+OH-,故答案为:X-+H2O?HX+OH-.
点评:本题考查了盐类的水解、强弱电解质浓度与离子的关系,巧妙利用原子守恒、电荷守恒是解题的关键.

练习册系列答案
相关题目
下列化学式只能表示一种纯净物的是( )
| A、CF2Cl2 |
| B、C3H6 |
| C、C6H12O6 |
| D、C2H6O |
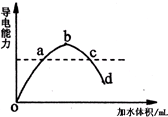 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示;请回答: